Polluants
NOx-NOy – oxydes d'azote
Les oxydes d’azote NOx = NO+NO2 sont des composés très réactifs qui sont au centre de la chimie atmosphérique à travers le rôle essentiel qu’ils jouent dans la formation photochimique de l’ozone troposphérique. Le monoxyde d’azote (NO) et le dioxyde d’azote (NO2) sont produits lors des processus de combustion de combustibles fossiles ou de biomasse (50%), mais aussi par de l’activité biologique dans les sols (31%) et par l’activité électrique des éclairs. NO et NO2 peuvent rapidement se transformer l'un en l'autre par l’intermédiaire de la
de NO2 sous l’action du rayonnement solaire et de la réaction de NO avec l’ozone. L'échange rapide entre NO et NO2 fait qu'on regroupe souvent ces deux espèces sous la forme d’une espèce unique: NOx. Plus les concentrations de NO2 seront fortes et celles de NO faibles, plus la production d'ozone troposphérique sera importante.
L’oxydation de NO2 dans l’atmosphère conduit à la formation d’acide nitrique HNO3 qui possède un temps de séjour dans l'atmosphère long. L’acide nitrique peut également régénérer les oxydes d’azote sous la forme NOx. C’est pourquoi on regroupe l’ensemble des oxydes d’azote dans une seule famille que l’on nomme communément, NOy = NOx + HNO3. L'acide nitrique est un acide fort qui a une influence directe sur le pH des eaux de pluies ; dans les zone fortement polluées, l’acidité des eaux de pluies peut atteindre des niveaux dommageables pour certaines espèces végétales (notamment forestières) et pour la faune et la flore aquatique dans les eaux continentales (lac et rivières) (voir fiche pluies acides).
Les oxydes d’azote ont un impact sur la santé humaine, soit directement soit indirectement. L’impact indirect se fait à travers la production d’ozone (notamment l’été) qui a lui-même un effet sur la santé (voir fiche O3). L'hiver, les épisodes de pollution concernent le NO2 formé dans les zones polluées. A des niveaux de concentration supérieurs à 200 µg/m3, le NO2 peut causer divers troubles respiratoires, neurologiques, hématologiques ou rénaux (voir fiche effet des polluants sur la santé).
I Introduction
L’oxyde d’azote le plus abondant dans l’atmosphère est le protoxyde d’azote (cf. fiche N2O) avec un rapport de mélange de l’ordre de 300 ppb, ce qui en fait le composé azoté le plus abondant après le diazote N2. De l’ordre de 20 millions de tonnes d’azote sous forme de N2O sont émis par an au niveau de la surface sans mécanisme de destruction chimique ou photochimique dans la troposphère (le temps de vie du N2O y est de l'ordre de 150 ans). Il est principalement détruit dans la stratosphère au-dessus de 20 km d’altitude, où il joue un rôle très important dans l’équilibre de l’ozone stratosphérique (voir fiche N2O). Mais en fait, ce sont d’autres formes des oxydes d’azote qui sont souvent étudiées en chimie troposphérique, car beaucoup plus réactives : le monoxyde d’azote (NO) et le dioxyde d’azote (NO2). Ces composés sont produits lors des processus de combustion de combustibles fossiles ou de biomasse (50%), mais aussi par l’activité biologique dans les sols (31%) et par l’activité électrique des éclairs d'orage. Ces émissions représentent environ 40 millions de tonnes d’azote sous forme de NO (essentiellement) et de NO2.
II-1 Les NOx
Le monoxyde et le dioxyde d’azote peuvent rapidement s’interconvertir par l’intermédiaire de la photolyse* de NO2 sous l’action du rayonnement solaire à des longueurs d’ondes inférieures à 400 nm) et de la réaction de NO avec l’ozone, selon le schéma réactionnel ci-dessous :
NO2 + hv (λ< 420nm) → NO + O3P (R-1) (où O3P est un atome d’oxygène dans l’état excité 3P)
O3P + O2+M → O3 +M (R-2)
NO + O3 → NO2 + O2 (R-3)
L'interconversion rapide entre NO et NO2 fait qu'on regroupe souvent ces deux espèces sous la forme d’une espèce unique : NOx = NO + NO2.
On remarquera que ce cycle correspond à un bilan nul d’un point de vue transformation chimique (c'est-à-dire qu'aucune espèce n'est produite ni détruite dans le processus). Comme pour la stratosphère, quand la concentration de O est faible, la proportion relative des 2 constituants NO et NO2est déterminée par l'équation [NO]/[NO2] = K/J [O3] dans laquelle K est la constante cinétique de la réaction (R-3) ci-dessus, et J le taux de photolyse de la réaction R-1. Le rapport [NO]/[NO2] dépend donc de la concentration en O3, de la température, et de l’intensité du flux solaire (λ <430 nm)
Cette interdépendance entre les composés NO, NO2 et l’ozone est facilement observable dans les atmosphères polluées des villes (voir Figure 1)
******* FIGURE MANQUANTE *******
Figure 1 :Variations caractéristiques des concentrations de NOx et d’ozone en atmosphère urbaine les jours ouvrables avec fort trafic automobile, et les jours chômés (week-end ou jours fériés)
******* FIGURE MANQUANTE *******
Le trafic automobile est une des principales sources d’oxydes d’azote en zone urbaine. Ces oxydes d’azote sont émis essentiellement sous forme de NO. C’est la raison pour laquelle un pic important de NO est observé le matin vers 9h, lorsque le trafic est le plus intense. Ce pic s’accompagne d’une forte augmentation de NO2 et d’une nette baise de la concentration d’ozone suite à la réaction du NO avec l’ozone conduisant à la formation de NO2 (réaction R-3), qui n’est pas compensée par une destruction photolytique importante du NO2 compte tenu de l’heure matinale. En journée un cycle plus stationnaire (équilibre production-destruction de l'ozone) s’établit.
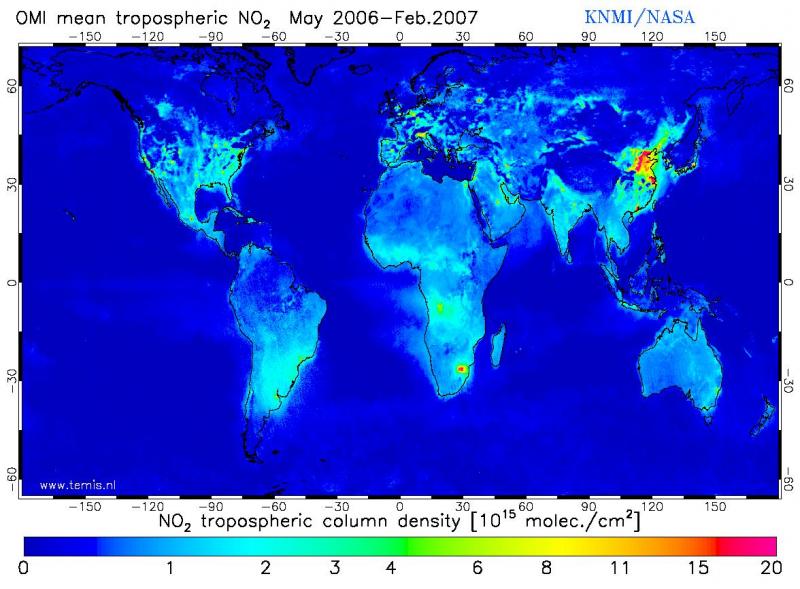
Dans l’atmosphère libre, hors des panaches de pollution, l’équilibre entre NOx et ozone dépend des conditions thermodynamiques atmosphériques. La diminution de la température et l’augmentation de Javec l’altitude impliquent notamment une proportion plus grande de NO dans la haute troposphère. Les sites de mesures des concentrations de NOx dans l’atmosphère sont beaucoup moins nombreux que pour l’ozone, mais un effort important a été accompli ces dernières années. Des mesures depuis l’espace par l’instrument GOME ou OMI permettent dorénavant de déterminer la variabilité spatiale des concentrations de NO2 intégrées sur la verticale depuis le sol jusqu’à la tropopause. La figure 2 montre que les concentrations sont plus fortes dans les zones de forte population ou d’activité industrielle importante. La grande réactivité des NOx ne leur permet pas d’avoir une distribution homogène, y compris à l’intérieur d’une même bande de latitude, où les vents zonaux peuvent rapidement mélanger les gaz émis en surface. Le temps de vie des NOx est de 1 jour dans la couche limite atmosphérique, et augmente jusqu'à 4 jours vers 10 km d’altitude. Cette dispersion par les mouvements zonaux de l’atmosphère explique cependant le voile de NO2 qui s’étend sur l’Atlantique Nord, le nord de l’océan Indien, et une bonne partie des océans de l’hémisphère Sud.
II-1 Les NOy- NOz
L’oxydation de NO2 dans l’atmosphère conduit à la formation d’acide nitrique HNO3. L’acide nitrique possède un temps de vie suffisamment long pour dominer les concentrations de NOx par un facteur 5-10 dans les masses d’air transportées loin des sources d’émissions. En dehors des régions émettrices de NOx, le temps de vie de HNO3 sera déterminé moins par des processus photochimiques, que par des phénomènes physiques liés à son excellente solubilité dans l’eau liquide. La présence d’eau liquide sous forme nuageuse dans la troposphère déterminera donc en grande partie l’élimination de l’acide nitrique du milieu atmosphérique. L’acide nitrique peut également régénérer les oxydes d’azote sous la forme NOx soit par photolyse, soit parréaction avec OH :
HNO3 + h (λ< 320nm) → NO2 + OH (R-4)
HNO3 + OH → NO3 + H2O (R-5)
NO3 + hν (< 670nm) → NO2 + O (R-6)
C’est pourquoi on regroupe l’ensemble des oxydes d’azote dans une seule famille que l’on nomme communément NOy = NOx + HNO3. La concentration des composés NOy n’est cependant pas très conservative dans la troposphère du fait de la perte de HNO3 par lessivage, mais aussi de la dilution des masses d’air issues des sources de pollution par de l’air plus propre. Le fait que HNO3 possède un temps de vie plus long que celui des NOx,et qu’il puisse régénérer des oxydes d’azote sous une forme plus réactive lui confère un rôle important dans l’atmosphère car il pourra jouer le rôle d'espèce réservoir* des oxydes d’azote réactifs.
Un autre composé joue aussi ce rôle dans la troposphère, il s’agit du nitrate de péroxy-acétyle ou Peroxy Acetyl Nitrate (PAN), autre produit d’oxydation de NO2 en présence de l’acétaldéhyde (CH3CHO), qui lui-même provient de l’oxydation de nombreux hydrocarbures possédant au moins 2 atomes de carbone (> C2).
Le PAN (CH3COO2NO2) est très stable à basse température, avec un temps de demi vie de l’ordre de 30 minutes à 25°C, et plusieurs jours à -20°C. Le PAN ne sera donc un réservoir effectif des NOx que dans la haute troposphère et dans les régions froides (région polaire et périodes hivernales). A la différence de l’ozone, la variabilité des concentrations des oxydes d’azote réactifs sera donc très dépendante de la réactivité chimique de l’atmosphère. Les rapports entre les différents constituants de la famille NOy permettent de caractériser cette réactivité. Les processus de transport rapide entre la basse et la haute troposphère, ainsi que la possibilité d’émission en altitude, sont aussi à prendre en compte car la partition de NOy dans ces différentes composantes (NOx, HNO3, PAN, ...) ne sera pas la même pour ces deux régions.
Dans la catégorie des NOy rentrent aussi d’autres oxydes d’azote comme N2O5, HONO… qui sont des espèces intermédiaires des réactions d’oxydation des composés de l’azote, ainsi que le radical NO3 qui est formé au cours de réactions de NO2 avec l’ozone
On définit enfin une dernière famille d’oxydes d’azote,lesNOz, qui regroupe tous les oxydes d’azote autres que les NOx : [NOz] = [NOy] – [NOx]. Dans une masse d’air polluée, la concentration des NOz augmente au détriment de la concentration des NOx à mesure que l’on s’éloigne de la source. Le rapport NOz/NOy caractérise le"vieillissement" chimique de la masse d’air,et donc son potentiel de production photochimique d’ozone.
II Sources et puits d’oxydes d’azote
Les émissions de composés azotés par les sols
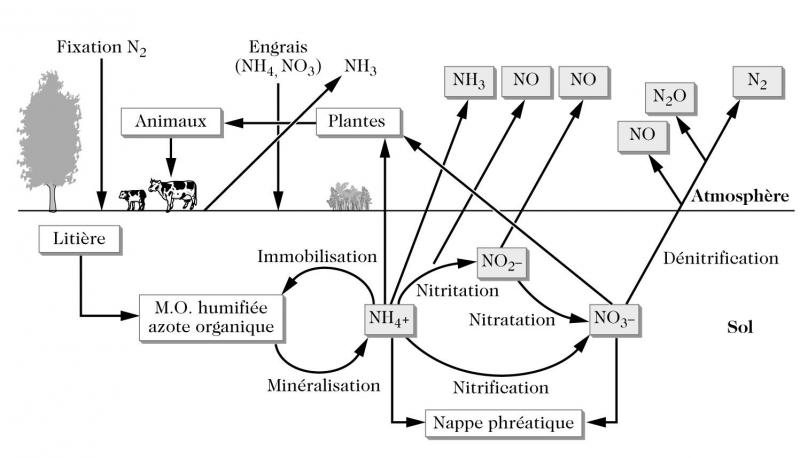
Les sols sont une source important de composés azotés gazeux qui ne limitent pas aux seuls oxydes d’azote. Le cycle de l’azote dans le sol est complexe. Il est constitué d’une succession d’étapes dans lesquelles interviennent diverses populations bactériennes. En dehors des plantes supérieures (légumineuses), qui fixent l’azote moléculaire dans des nodules, l’azote est essentiellement ré-assimilé par les plantes sous forme minérale. Or, l’azote du sol se présente majoritairement sous forme organique (généralement à plus de 95 %). L’azote organique subit donc d’abord une minéralisation qui se traduit par la formation d’ammonium (ammonification). Les ions ammonium formés sont ensuite oxydés en nitrates (nitrification), via la formation de nitrites, ces transformations nécessitent de l’oxygène (bactéries aérobies). Finalement, si les nitrates migrent dans une zone faiblement oxygénée ou anoxique, ils peuvent être réduit en azote moléculaire (dénitrification) qui retourne à l’atmosphère, fermant ainsi le cycle de l’azote. Cependant, au cours de ces transformations, l’azote minéral passe par des formes gazeuses (NH3, NO, N2O). La nitrification est considérée comme la source principale de la production de NO par de sol, tandis que la dénitrification est la source majeure de N2O. Ces deux composés peuvent être émis vers l’atmosphère sous forme gazeuse lorsque les conditions de transfert liées à la porosité, et donc à l’humidité du sol, le permettent. Ces pertes sont faibles par rapport aux quantités d’azote échangées dans le sol (de l'ordre du pourcent), mais elles sont d’un intérêt tout à fait important pour la physico-chimie de l’atmosphère. Les principaux facteurs de contrôle des émissions sont la température et l’humidité du sol, et la quantité de substrat azoté mis en jeu. Ce dernier dépend soit de la biomasse présente, soit d’apports externes sous forme d’engrais azotés organiques ou chimiques. Une émission d’ammoniac peut également intervenir lors du processus d’ammonification, mais seulement dans le cas de sols très basique (pH > 8), ce qui peut être le cas de sols agricoles fertilisés et chaulés. L’essentiel de la production d’ammoniac atmosphérique résulte plutôt de la décomposition enzymatique de l’urée des lisiers et de la décomposition d’autres déchets issus de l’élevage intensif (cf. fiche NH3).
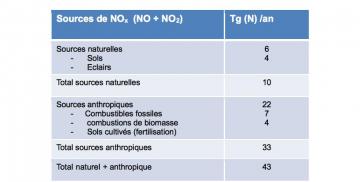
Outre les émissions des sols, les autres sources importantes d’oxydes d’azote sont principalement les combustions de combustibles fossiles et de biomasse, et les décharges électriques dans les nuages d’orage. Les mécanismes d’émission associés à ces différentes sources sont détaillés dans les fiches relatives aux sources anthropiques et aux sources naturelles de composés atmosphériques. Les principales sources d’oxydes d’azote (cf. tableau 1) sont les combustions de combustibles fossiles (22 TgN/an). Au sein de cette source, il faut distinguer le transport aérien qui contribue pour une part modeste quantitativement (0,5 Tg/N/an), mais néanmoins significative, car cette source injecte des oxydes d’azote à l’altitude de vol de avions (10-12km) où leur réactivité est plus faible et où leur temps de séjour dans l’atmosphère* sera 4 à 5 fois plus long que dans la couche limite. Globalement les émissions d’origine humaine d'oxydes d’azote sont 3 fois supérieures aux émissions naturelles, entraînant diverses conséquences pour l’atmosphère et les milieux naturels. La source majeure d’oxydes d’azote, la combustion des combustibles fossiles, ne présente pas de tendance à la diminution, malgré une nette amélioration des rejets de NOx par les nouveaux véhicules automobiles, et ceci, en raison de l’augmentation continue du parc automobile.
| Sources de NOx (NO + NO2) | Tg (N) /an |
| Sources naturelles
| 6 4 |
| Total sources naturelles | 10 |
| Sources anthropiques
| 22 7 4 |
| Total sources anthropiques | 33 |
| Total naturel + anthropique | 43 |
Tableau 1 :Sources d’oxydes d’azote pour l’atmosphère en Tg (millions de tonnes) d’azote sou forme de NO (principalement) ou de NO2.
III Les oxydes d’azote dans l’atmosphère
Les oxydes d’azote sont des composés très réactifs qui, comme on l’a vu, sont au centre de la chimie atmosphérique à travers le rôle essentiel qu’ils jouent dans la formation photochimique de l’ozone troposphérique.
Au terme de la chaine d’oxydation atmosphérique, les oxydes d’azote se transforment en acide nitrique. Cet acide fort a une influence directe sur le pH des eaux de pluies ; dans les zone fortement polluées, l’acidité des eaux de pluies peut atteindre des niveaux critiques pour certaines espèces végétales (notamment forestières) et pour la faune et la flore aquatique dans les eaux continentales (lac et rivières) (voir fiche pluies acides).
Enfin les oxydes d’azote ont un impact sur la santé humaine, soit directement soit indirectement. L’impact indirect est lié à leur contribution aux épisodes de pollution à l’ozone qui interviennent notamment l’été. En période hivernale, où la photochimie est ralentie par les faibles niveaux de rayonnement solaire, les épisodes de pollution concernent directement le NO2 formé dans les panaches pollués ou les atmosphères urbaines par oxydation du NO par l’ozone. Les faibles taux de photolyse ne permettent pas la destruction du NO2 qui s’accumule pour atteindre des niveaux de concentration élevés. A des niveaux de concentration supérieurs à 200 µg/m3, le NO2 peut causer divers troubles respiratoires, neurologiques, hématologiques ou rénaux (voir fiche effet des polluants sur la santé).