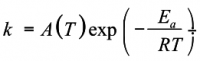Mécanismes
Transformations chimiques
I Introduction
Les transformations chimiques des constituants mineurs atmosphériques primaires issus des différentes sources se divisent en: transformations en phase homogène gazeuse et transformations multi-phasique (gaz ↔ liquide, gaz ↔ solide, liquide ↔ solide). Dans tous les cas, il s'agit essentiellement de réactions d'oxydation, l'atmosphère est en effet un milieu oxydant. En phase gazeuse, le processus d'oxydation se fait lors de réactions chimiques ou photochimiques induites par des molécules oxydantes telles que l'ozone et les radicaux libres (hydroxyles-OH•, peroxyles-HO2•, RO2•, organiques-R•). Les mécanismes d'oxydation sont des processus complexes impliquant de nombreuses étapes élémentaires et espèces intermédiaires. On appelle mécanisme réactionnel l'enchaînement de ces étapes. Ces mécanismes réactionnels, qui peuvent se résumer par une équation-bilan, donnent une information sur les proportions relatives des espèces produites ou consommées. En fait, ce mécanisme peut souvent se décomposer sous la forme de réactions élémentaires, qui par définition, ne peuvent être décomposées en étapes plus simples. La vitesse de la réaction globale va dépendre de la vitesse de chacune de ces réactions élémentaires. Lorsque les transformations chimiques impliquent de nombreuses réactions élémentaires, il n'existe alors pas de relation simple pour décrire l'évolution des concentrations dans le temps. C'est le cas par exemple du mécanisme réactionnel de l'oxydation du méthane dans l'atmosphère qui implique plusieurs dizaines de réactions élémentaires et d'intermédiaires réactionnels.
II Approximation de l'état quasi-stationnaire
La mesure expérimentale de la vitesse d'une transformation chimique fournit une information sur le mécanisme réactionnel de cette transformation. Cependant, même pour des mécanismes "simples", comprendre le lien entre la loi de vitesse observée pour la réaction globale et le jeu d'équations différentielles associé n'est généralement pas possible. Aussi, on cherche des hypothèses permettant de simplifier le système réactionnel, comme l'hypothèse de l'approximation de l'état quasi-stationnaire. Les transformations impliquant plusieurs réactions élémentaires font généralement intervenir les intermédiaires. Ces intermédiaires sont des espèces très réactives: ils ne s'accumulent pas, leurs concentrations restent négligeables devant celles des réactifs initiaux et des produits terminaux. Ces intermédiaires atteignent rapidement un état dynamique, c'est-à-dire que leur vitesse de consommation tend vers leur vitesse de production, l'espèce est donc à l'état quasi-stationnaire. Mathématiquement, cela revient à annuler la dérivée temporelle de leur concentration.
III Influence de la température, énergie d'activation
La vitesse d'une réaction dépend très généralement de la température T. Pour de nombreuses réactions, la variation de la constante cinétique k avec T peut être ajustée avec:
Où A et Ea sont des paramètres caractéristiques de la réaction:
- Ea a la dimension d'une énergie, c’est l’énergie d'activation
- A a la dimension de k, c’est le facteur de fréquence
Remarque: lorsque l'on est dans le cas où A(T) ne dépend pas de T, on retrouve la forme d'Arrhenius.
Les molécules gazeuses peuvent réagir entre elles lorsqu'elles sont suffisamment près les unes des autres pour échanger de l'énergie, et former de nouvelles liaisons. Le taux de réaction entre deux molécules entrées en collision est donné par la relation d'Arrhenius. La réaction ne peut avoir lieu que si l'énergie cinétique des 2 molécules entrant en collision excède une énergie seuil: c'est l'énergie d'activation Ea. Lorsque l'on a une réaction entre deux espèces radicalaires (cf définition plus loin), l'énergie d'activation est proche de zéro (réaction très facile), la réaction est très exothermique et l'excédent d'énergie (ou variation d'enthalpie, voir ci-dessous) est alors absorbé par un troisième corps. C'est le cas par exemple de la réaction de formation de l'ozone R-1 qui dégage une énergie de l'ordre de 100 kJ.mol-1, et qui est notamment responsable de l'augmentation de température avec l'altitude dans la stratosphère:
O+O2 → O3 R-1
Les réactions mettant en jeu une espèce radicalaire et une molécule dans un état stable sont exothermiques, elles sont très fréquentes dans l'atmosphère, et se caractérisent par des niveaux d'énergie d'activation compris entre 0 et 60 kJ.mol-1.
Enfin, les réactions entre espèces stables sont quasi-impossibles dans l'atmosphère, et se caractérisent par des énergies d'activation comprises entre 80 et 200 kJ.mol-1.
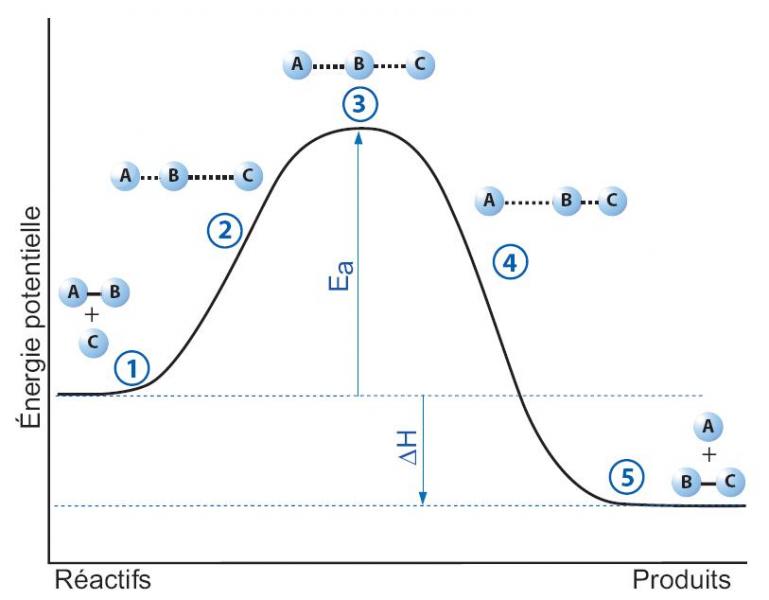
Soit par exemple la réaction A-B + C ↔ A + B-C. La figure 1 montre la variation de l'énergie potentielle en fonction de la distance entre les 2 molécules. Lorsque les 2 molécules sont approchées, l'énergie augmente pour atteindre un maximum. On a alors un complexe d'activation ABC‡ qui est un état transitoire. L'énergie d'activation précédemment définie correspond ici à la différence d'énergie entre l'état initial et l'état transitoire. La différence d'énergie potentielle entre l'état initial et l'état final correspond à l'énergie libérée ou consommée par la réaction, généralement sous forme de chaleur, c'est la variation d'enthalpie ΔH de la réaction. Dans le cas illustré, la réaction est exothermique (ΔH < 0).
IV Photochimie atmosphérique
Le flux d'énergie essentiel dans la chimie atmosphérique est le flux de rayonnement solaire. Le soleil émet un rayonnement couvrant les domaines allant de l'ultraviolet à l'infrarouge avec les gammes de longueurs λ suivantes:
- Ultraviolet: 150 < λ < 400 nm
- Visible: 400 < λ < 800 nm
- Infrarouge (proche, moyen et lointain): 800 < λ < 15000 nm
Parmi ces rayonnements, les longueurs d'onde les plus courtes (λ < 290 nm) sont arrêtées dans la stratosphère entre 20 et 50 km d'altitude (principalement par l'ozone qui les absorbe). Les réactions photochimiques (qui utilisent le rayonnement solaire, plus précisément les photons émis par celui-ci) qui ont lieu dans la troposphère se font donc à des longueurs d'onde supérieures, comprises entre 290 et 400 nm.
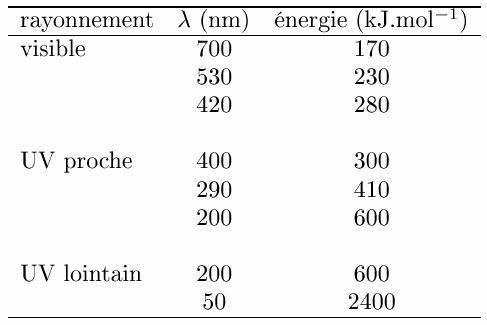
La photochimie est l'étude des réactions induites par la lumière. L'absorption d'un photon par une molécule amène celle-ci dans un état électronique excité, plus propice à une transformation chimique que l'état fondamental. Dans une réaction photochimique, le photon fournit l'énergie requise pour surmonter la barrière de potentiel (énergie d'activation) associée à la transformation. Les réactions entre molécules stables étant quasiment impossibles, les réactions photochimiques jouent un rôle central en chimie de l'atmosphère: elles représentent la principale source de radicaux dans la troposphère, et permettent ainsi d'initier les transformations en phase gazeuse. En fonction de la loi de Planck, l'énergie d'un photon est proportionnelle à sa fréquence ν et inversement proportionnelle à sa longueur d'onde λ. Ainsi, d'après cette loi, plus la longueur d'onde d'un photon est faible, plus l'énergie qui lui est associée est importante (cf tableau 1).
Tableau 1: Longueur d'onde et énergie des photons dans le domaine du visible, et des UV proches et lointains.
En remarque, on notera que les rayonnements de longueurs d'onde plus grandes que le rayonnement visible (λ > 800 nm) présentent peu d'intérêt en photochimie. En effet, le rayonnement n'est alors pas assez énergétique pour amener les molécules dans un état électronique excité. Dans le cas du rayonnement UV, l'énergie des photons est du même ordre de grandeur ou supérieure à l'énergie des liaisons dans certaines molécules. Dans ce cas-là, de l'énergie est absorbée par l'atome (ou la molécule) étudié qui se retrouve dans un état d'excitation (il faut pour cela que le niveau supérieur d'excitation soit "autorisé" par la théorie de la mécanique quantique). Une fois excitée, la molécule peut évoluer selon différents processus physiques et chimiques: luminescence, désactivation par collision, ionisation, réaction bimoléculaire, rupture de liaisons chimiques (dissociation). On parlera alors de photoionisation, photodissociation…. Parmi les processus mentionnés, la photolyse (ou photodissociation) présente un intérêt majeur en chimie atmosphérique: c'est la principale source de radicaux. En général, elle conduit à la rupture d'une liaison chimique selon:
A–B + hν ↔ A• + B• R-2
où A et B sont des fragments radicalaires ou des atomes. Les radicaux se caractérisent par la présence d'une orbitale libre (symbolisée par le point) qui les rend très réactifs, et donc de durée de vie très courte.
La photolyse d'une molécule n'est possible que si l'énergie du photon absorbé est supérieure ou égale à l'énergie de la liaison rompue. Toutefois, l’irradiation d’une molécule par des photons d’énergie supérieure aux énergies de liaison ne conduit pas systématiquement à une photolyse: rien n’indique a priori que la molécule peut absorber les photons dans la gamme de longueur d'onde considérée. Par ailleurs, il faut noter que les produits de la réaction de photolyse peuvent eux-mêmes être produits dans un état excité, et ceci en fonction de la valeur de la longueur d'onde responsable de la photolyse. Ainsi, la photolyse de l'ozone peut mener à deux formes différentes de l'atome d'oxygène.
Pour λ < 310 nm, l'atome est dans l'état excité nommé 1D: O3 + hν → O(1D) + O2
Pour λ > 310 nm, l'atome est dans l'état fondamentale 3P: O3 + hν → O(3P) + O2
Les réactions de photolyse sont des processus unimoléculaires comme on peut le voir dans la réaction R-2. Une telle réaction a une vitesse qui s'exprime avec:
V = kp [AB]
où kp est la constante de photolyse. Elle a la dimension de l'inverse d'un temps, et est fréquemment qualifiée de "fréquence de photolyse". En chimie atmosphérique, elle est notée J. Cette fréquence va varier en fonction des propriétés intrinsèques des molécules réagissant (fraction des molécules excitées étant effectivement photolysées, et capacité d’absorption encore appelée section efficace d'absorption de ces molécules) et des conditions de rayonnement dans le milieu atmosphérique (flux total de photons reçus, toutes directions confondues, par unité de surface, fonction de l’altitude, de l’angle zénithal et de la couverture nuageuse).
La photolyse va donc produire des radicaux, on parlera alors d'une phase d'initiation. Cette phase va être ensuite suivie d'une phase de propagation qui se caractérise par des réactions en chaîne entre radicaux et espèces stables (de type A• + BC AB + C•). Ces réactions peuvent être interrompues par des réactions dites de terminaison dans lesquelles deux radicaux réagissent entre eux pour redonner une espèce stable A• + B• AB ou A• + B• C + D).
V Radical OH
La réaction de photolyse de l'ozone précédemment décrite est fondamentale pour la chimie de l'atmosphère, et en particulier la réaction menant à la forme excitée de l'atome d'oxygène O1D. En effet, cette réaction est la source de production du radical OH selon:
O(1D) + H2O → 2 OH• R-3
Le radical est le principal responsable des réactions d'initiation radicalaire dans l'atmosphère. A ce titre, il est responsable de l'oxydation et donc de la destruction d'un grand nombre de composés chimiques dans l'atmosphère pour lesquels il peut représenter jusqu'à 90 ou 100% du puit atmosphérique (cas de CH4 et CO respectivement). La concentration en OH définit la capacité oxydante de l’atmosphère, et donc la capacité de celle-ci à contrôler les niveaux des espèces en trace, que celles-ci contribuent au réchauffement global (CH4 par exemple) ou à la pollution photochimique (CO, CH4, COV, NOx, cf ci-dessous). Les espèces comme le N2O ou les CFCs, qui ne sont pas du tout dégradées par le radical OH, ont des temps de vie beaucoup plus long (supérieurs à plusieurs décennies), qui font qu'ils peuvent être transférés depuis la troposphère jusque dans la stratosphère.
Le radical OH va d'une manière générale attaquer les hydrocarbures (formule générique R-H) sur lesquels il va arracher un proton pour former un radical R•. Ce radical réagira ensuite très rapidement avec l'oxygène de l'air pour donner des radicaux péroxyles RO2•. Ces radicaux RO2• interviendront ensuite dans l'équilibre photostationnaire de l'ozone. En effet, les radicaux péroxyles favorisent l'oxydation du monoxyde d'azote en dioxyde d'azote selon la réaction R-4
RO2• + NO → RO• + NO2 R-4
Cette réaction augmente le taux de production d'ozone car celui-ci dépend du rapport [NO2]/[NO]. Un ensemble de réactions faisant intervenir les hydrocarbures, les oxydes d'azote et l'oxygène de l'air vont ainsi, par propagation des formes radicalaires OH•, HO2•, RO2• et RO•, favoriser l'oxydation des composés carbonés et la production d'ozone. Celle-ci sera ainsi dépendante de la proportion des oxydes d'azote et des hydrocarbures en présence. Lorsque la quantité relative de COV est trop importante par rapport aux NOx, il n'y a pas suffisamment de radicaux RO2• produits pour oxyder le NO et produire de l'ozone (réaction R-4 minimisée). A contrario, si la proportion de COV est trop importante, alors il n'y a pas assez de NO pour recycler tous les radicaux HO2• en OH•, et le nombre de réactions de terminaison entre radicaux (du type HO2• + HO2• ↔ H2O2 +O2 ou OH• + HO2• ↔ H2O +O2), est important.
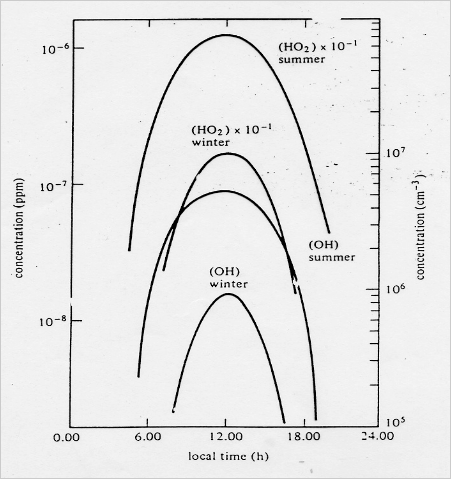
Le radical OH• est très réactif, sa durée de vie dans des atmosphères propres est de l'ordre de la seconde. Par conséquent, ce composé joue le rôle d'intermédiaire réactionnel, il ne s'accumule pas dans l'atmosphère, et ses concentrations troposphériques sont extrêmement basses, de l'ordre de 1 à 10 106 molécule cm−3 le jour au maximum. Le HO2• a une durée de vie plus longue (~100 s) avec une concentration maximale typique de jour de ~108 molécule cm−3. Les concentrations des radicaux OH• et HO2• évoluent rapidement avec les changements des conditions ambiantes locales, comme le flux solaire et les niveaux de NOx ou des hydrocarbures. Typiquement, les concentrations sont plus fortes l'été que l'hiver, et maximums autour de midi (photochimie plus intense), cf figure 2.
VI Réactions hétérogènes
Les réactions hétérogènes, en particulier celles intervenant à la surface des aérosols, peuvent être importantes, notamment dans la stratosphère (cf. fiche chimie des aérosols). On sait que la disparition de l'ozone aux pôles aux printemps de chaque hémisphère est liée à la présence de cycles catalytiques de destruction halogénés. Cependant, la seule chimie en phase homogène, du chlore et du brome entre autre, ne suffit pas à expliquer les taux de destruction observés. Ce sont bien des réactions en phase hétérogène, intervenant à la surface des cristaux de glace se formant dans les nuages stratosphériques polaires (voir définition glossaire) qui permettent de transformer suffisamment de chlore (ou brome) inactif (HCl ou ClONO2) car piégé dans des espèces réservoirs*, en chlore (ou brome) actif (Cl2) disponible pour les cycles catalytiques de destruction.