Effets
Couche d'ozone
L’origine de la couche d’ozone stratosphérique
L’ozone stratosphérique se forme à haute altitude par photolyse du dioxygène (O2). La
« casse » la molécule et le dioxygène libère de l’oxygène monoatomique (O). En se combinant avec une autre molécule de dioxygène, cet oxygène monoatomique donne une molécule d’ozone (O3). Naturellement, les molécules d’ozone formées n’ont pas une durée de vie infinie sinon tout l’oxygène de l’atmosphère serait transformé en ozone. Ces molécules sont elles même cassées par photolyse pour redonner du dioxygène et des atomes d'oxygène. C’est le mécanisme dit de Chapman.
Les perturbations de la couche d’ozone stratosphérique
Dans les années 1970, Crutzen, Molina et Rowland (Prix Nobel de Chimie 1995) ont eu l'idée d’ajouter aux mécanismes de Chapman un cycle catalytique de destruction de l'ozone. Ce cycle fait intervenir un radical libre catalyseur qui peut être H, OH, NO, Cl ou Br. Le cycle est catalytique car le composé est régénéré à la fin du cycle. Il transforme deux molécules d'oxygène réactif (O ou O3) en deux molécules d'oxygène moléculaire inerte (O2). L'importance relative d'un cycle correspondant à un composé donné dépend de la concentration de ce composé et des vitesses de réaction. Certains des catalyseurs des réactions de destruction sont issus de molécules créées par l’homme: les chlorofluorocarbures (CFC).
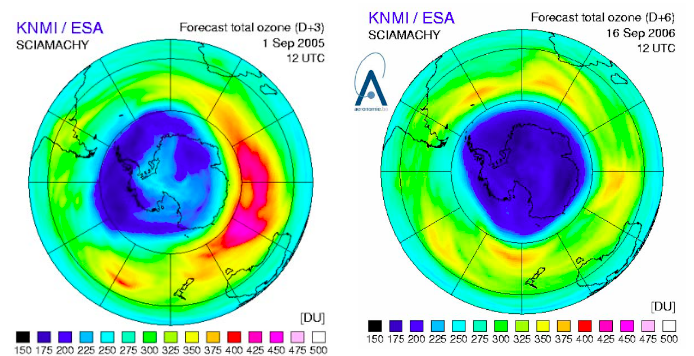
Le trou d’ozone polaire
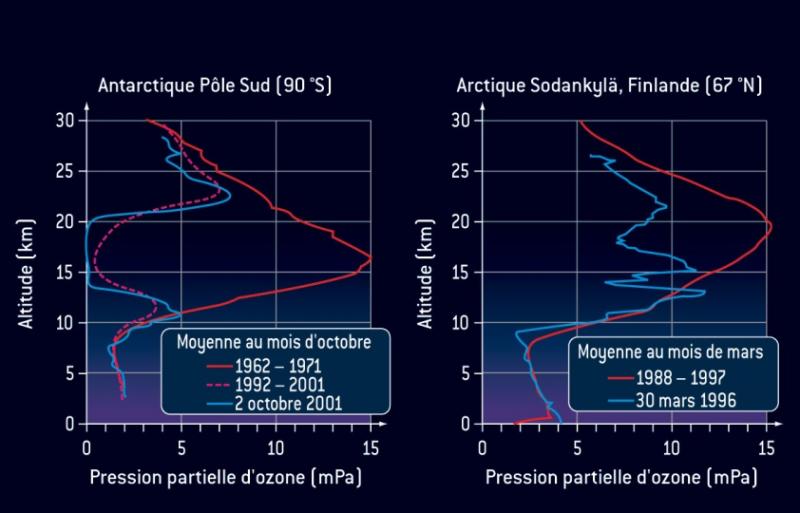
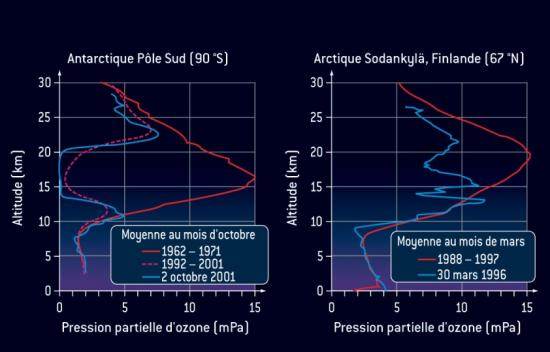
Dans la stratosphère, les cycles catalytiques aboutissent à la formation d’espèces dites "espèces réservoir" qui jouent un rôle central dans le cycle de destruction de l'ozone. Par exemple, les espèces réservoirs HCl et ClONO2 retiennent 99% du chlore actif. Les différentes espèces réservoir sont détruites par l’action du rayonnement solaire (photolyse), et libèrent alors le chlore actif qui détruit l’ozone. C’est ce phénomène qui explique la formation du trou d’ozone dans la stratosphère polaire. La formation d’espèces réservoir y est en particulier favorisée par la présence de nuages de glace (nuages stratosphériques polaires). Ces espèces s’accumulent pendant la nuit polaire où la présence d’un vortex contribue à leur piégeage. Au printemps (septembre-octobre dans l’Hémisphère Sud, mars-avril dans l’Hémisphère Nord), la photolyse des espèces réservoir libère le chlore actif qui détruit l’ozone.
I L’origine de la couche d’ozone stratosphérique
L’ozone stratosphérique se forme à haute altitude par photolyse du dioxygène (O2). La photolyse est l'absorption d’un photon solaire ultra-violet (UV) de courte longueur d’onde qui a une énergie suffisante pour "casser" la molécule. Dans le cas présent, le dioxygène libère de l’oxygène monoatomique (O). En se combinant avec une autre molécule de dioxygène, cet oxygène monoatomique donne une molécule d’ozone (O3). Naturellement, les molécules d’ozone formées n’ont pas une durée de vie infinie sinon tout l’oxygène de l’atmosphère serait transformé en ozone. Ces molécules sont elles même cassées par photolyse pour redonner du dioxygène et des atomes d'oxygène. Ces réactions sont résumées ci-dessous.
Dans la stratosphère, à une altitude supérieure à 30 km, le rayonnement UV de longueur d'onde inférieure à 240 nm dissocie lentement le dioxygène :
O2 + hν <-> O + O (hν représente l’énergie du photon solaire).
L'atome d'oxygène O réagit rapidement avec le dioxygène, en présence d'une tierce molécule M (une autre molécule de O2, ou N2) pour former de l'ozone :
O + O2 + M <-> O3 + M.
La molécule d'ozone formée absorbe le rayonnement UV entre 240 et 320 nm, et peut se décomposer pour reformer O et O2:
O3 + hν <-> O2 + O.
L'ozone peut aussi réagir avec l'atome d'oxygène pour redonner du dioxygène :
O3 + O <-> O2 + O2.
La quantité d’ozone dans la stratosphère résulte donc d’un équilibre entre formation et destruction naturelles ; ce processus bien connu est appelé mécanisme de
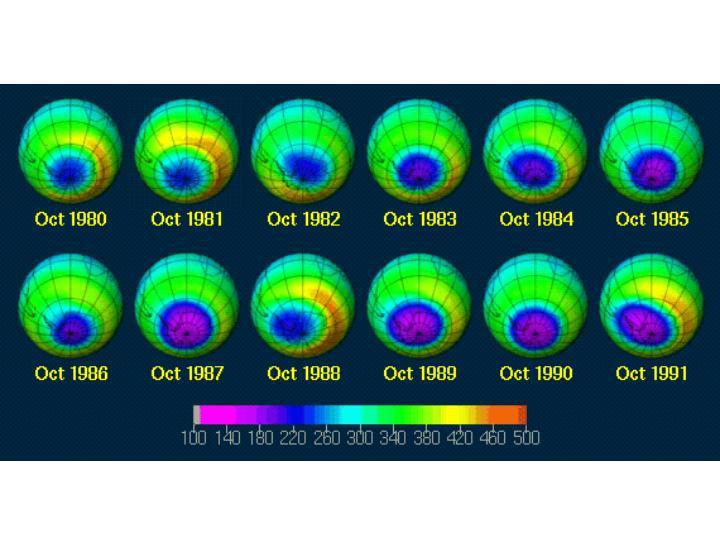
Jusqu'en 1964, on a pensé que le mécanisme de Chapman suffisait à décrire la formation et la destruction de l'ozone dans la stratosphère. L’amélioration de la mesure du taux de réaction du cycle de Chapman a montré que ce taux était considérablement plus faible que prévu et conduisait a des concentrations d'ozone beaucoup trop fortes. Les mesures d'ozone stratosphérique ont donné des valeurs deux fois plus faibles que celles prédites par les équations de Chapman. Il existe donc des mécanismes de destruction de l'ozone non pris en compte dans le mécanisme de Chapman. Pour que l'ozone soit détruit, il faut, soit qu'il existe un composé en grande quantité qui ait la propriété de détruire l'ozone, soit que la destruction de l'ozone soit du type catalytique (c’est-à-dire que la molécule agissante soit régénérée dans la chaîne de réaction et puisse à nouveau déclencher la réaction de destruction d’une autre molécule d’ozone). C’est ce dernier type de mécanisme qui a été mis en évidence au terme de nombreuses études commencées au début des années 1970 à propos de l’impact possible des vols supersoniques (Concorde) sur la couche d’ozone stratosphérique. Ces études ont connu un nouvel essor après la découverte du "trou d’ozone" dans la stratosphère antarctique au début des années 1980.
II Les perturbations de la couche d’ozone stratosphérique
Dans les années 1970, Crutzen, Molina et Rowland (Prix Nobel de chimie 1995) ont eu l'idée d’ajouter aux mécanismes de Chapman un
de destruction de l'ozone dont voici la forme générale:
X + O3 -> XO + O2
XO + O -> X + O2
_____________________
Net: O3 + O -> O2+ O2
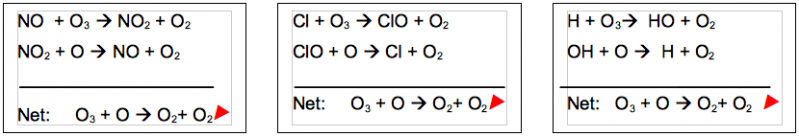
Ici, X représente un radical libre catalyseur qui peut être H, OH, NO, Cl ou Br. Le cycle ci-dessus est catalytique car le composé X est régénéré à la fin du cycle. Le cycle transforme deux molécules d'oxygène réactif Ox (O ou O3) en deux molécules d'oxygène moléculaire (O2) inerte. L'importance relative d'un cycle correspondant à un composé X donné dépend de la concentration de ce composé, et des taux des réactions constituant le cycle.
Les principaux cycles catalytiques intervenant dans la destruction de l’ozone sont:
- le Cycle des HOx (H, OH, HO2), radicaux contenant de l'hydrogène ;
- le Cycle des oxydes d'azote NOx (NO, NO2) ;
- le Cycle des ClOx (Cl, ClO), composés contenant des dérivés du chlore en provenance des CFC.
Par exemple :
Les trois exemples ci-dessus montrent comment la présence dans la stratosphère de composés de type HOx, NOx ou ClOx aboutit à une destruction nette d’ozone. Il faut noter que le composé qui cause la destruction de l’ozone, (ici NO, Cl, ou H) est régénéré au cours du cycle réactionnel, et peut donc engendrer la destruction de nouvelles molécules. On estime ainsi qu'une molécule de chlore, par exemple, peut détruire jusqu’à 10 000 molécules d’ozone avant d’être éliminée du réservoir stratosphérique. Il ne s’agit là que de trois exemples de réactions possibles. Les cycles catalytiques de destruction de l’ozone dans la stratosphère sont très complexes et interdépendants. Les cycles des NOx, HOx et ClOx sont en effet tous couplés, et leurs interactions gouvernent fortement la chimie de l'ozone stratosphérique. Leur influence relative varie notamment avec l’altitude. Ces couplages aboutissent à la formation d’espèces dites "espèces réservoir". L'existence d'espèces réservoirs joue un rôle central dans le cycle de destruction de l'ozone. Par exemple, les espèces HCl et ClONO2 retiennent 99% du chlore actif. On imagine aisément qu'un faible changement de la concentration de ces espèces peut avoir une forte influence sur l'efficacité relative des cycles dans lesquels ils interviennent. La répartition du chlore entre les espèces réactive (Cl, ClO) et les espèces réservoirs (HCl, HOCl, ClONO2) dépend de la température, de l'altitude et de la latitude de la masse d'air étudiée.
III Le trou d’ozone polaire
Les différentes espèces réservoir sont détruites par l’action du rayonnement solaire (
), et libèrent alors le chlore actif qui détruit l’ozone. C’est ce phénomène qui explique la formation du trou d’ozone dans la stratosphère polaire. La formation d’espèces réservoir y est en particulier favorisée par la présence de nuages de glace (les PSC ou
). Les espèces réservoir s’accumulent pendant la nuit polaire où la présence d’un
contribue à leur piégeage. Au printemps (septembre-octobre dans l’Hémisphère Sud, mars-avril dans l’Hémisphère Nord) la photolyse des espèces réservoir libère le chlore actif qui détruit l’ozone.
Le phénomène dutrou d’ozone stratosphérique a été clairement identifié comme lié au chlore en excès injecté dans la stratosphère avec les
(CFC). Il n’existe pas de molécule de CFC naturelle (à l’exception notable du chlorure de méthyle produit par les océans).
La mise en évidence au début des années 1980 de déficits saisonniers importants et anormaux de la colonne d’ozone au-dessus des pôles a conduit, dès 1987, à la signature de la convention de Vienne pour la protection de la couche d’ozone. Cette convention encourageait les travaux de recherche, la coopération et l’échange d’information entre les États, ainsi que des mesures législatives nationales, sans pour autant exiger de mesures concrètes en matière de limitation des émissions de chlorofluorocarbures et autres substances halogénées destructrices de l’ozone stratosphérique. Cette convention a été suivie en 1987 par le protocole de Montréal qui, en revanche, a imposé un calendrier et des objectifs d’arrêt de la production et de la commercialisation d’une première liste de substances (chlorofluorocarbures). Ces accords internationaux produisent leurs premiers effets et les observations permettent de noter une diminution ou une stabilisation dans l’atmosphère de certaines substances impliquées. Cependant les gaz incriminés ont des durées de vie longues (plusieurs dizaines d’années) et il faudra encore quelques dizaines d'années pour que les niveaux d’ozone dans la stratosphère reviennent à des valeurs "naturelles".
L’incertitude sur l’évolution future de la couche d’ozone reste importante, car si les CFC produits par l’industrie peuvent être contrôlés, il est plus difficile maîtriser les sources de NOx et de HOx, composés également responsable de la destruction de l’ozone stratosphérique. La principale source de NOx est la photolyse du protoxyde d’azote (N2O) dont l’augmentation dans l’atmosphère, liée pour l’essentiel aux pratiques agricoles, se poursuit. La vapeur d’eau, principale source de HOx dans la stratosphère, continue aussi à augmenter. La cause de cette augmentation n’est pas complètement connue.