Polluants
CFC (et HCFC et HFC) - Chlorofluorocarbures
Les
ou CFCs font partie de la famille des
, c'est-à-dire des hydrocarbures contenant au moins un
. Cette famille comprend les CFCs, et différentes familles de molécules combinant carbone, hydrogène et halogènes.
A noter que tous les CFCs, à l’exception notable des chlorure et bromure de méthyle qui peuvent être émis par les océans, sont d'origines anthropiques.
Usages
Les CFCs sont des composés incolores, inodores, et non corrosifs à l’état gazeux ou liquide. Ils ont été utilisés comme réfrigérants à partir des années 1930, usage qui est resté prédominant dans l'utilisation de ces composés. Ils ont été également utilisés comme gaz propulseurs des aérosols, comme matières premières dans la synthèse de composés organiques, comme solvants (nettoyage industriel), comme extincteurs, et comme agents d’expansion dans les mousses de matières plastiques.
Effets des CFCs sur la chimie de l'atmosphère
En raison de leur grande stabilité (quelques dizaines d'années à plus d'un siècle), les CFCs sont susceptibles d'atteindre la stratosphère où ils peuvent se dissocier pour former des atomes de chlore qui participeront à la destruction de l'ozone (cf. fiche couche O3). La mise en évidence au début des années 1980 de pertes importantes et anormales de la colonne d’ozone au-dessus des pôles a conduit, dès 1985, à la signature de la convention de Vienne pour la protection de la couche d’ozone. Cette convention a été suivie en 1987 par le protocole de Montréal qui a imposé un calendrier et des objectifs d’arrêt de la production et de la commercialisation d’une première liste de CFCs.
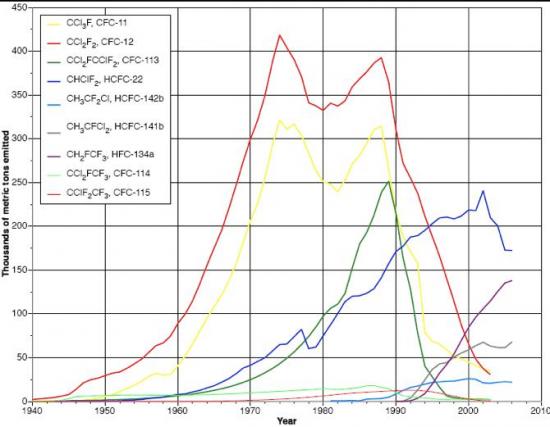
En Europe, depuis le 1er octobre 2000, les CFCs ne peuvent plus être mis sur le marché et doivent être impérativement récupérés et détruits depuis le 1er janvier 2002 (DEEE). Comme on peut le voir sur la figure, les émissions de CFC n'ont cessé de diminuer depuis la fin des années 1980.
I Introduction
Les chlorofluorocarbures ou CFCs font partie de la famille des halocarbures, c'est-à-dire des hydrocarbures contenant au moins un composé halogéné. La famille des halocarbures comprend les CFCs (halocarbures avec des atomes de carbone, fluor, et chlore), les Hydrochlorofluorocarbures ou HCFCs (halocarbures avec des atomes de carbone, fluor, chlore et hydrogène) les Hydrofluorocarbures ou HFCs (halocarbures avec des atomes de carbone, fluor, et hydrogène), les perhalocarbures (halocarbures où chaque liaison carbone est occupé par un halogène) et les halons (halocarbures contenant des atomes de brome). Les CFCs sont des gaz composés dérivés des alcanes (de 1 à 4 atomes de carbone), ou tous les atomes d'hydrogène ont été substitués par des atomes de chlore et de fluor. Contrairement à d'autres halocarbures, comme par exemple les hydrochlorofluorocarbures (HCFC), les CFCs ne contiennent plus d'atome d'hydrogène; ces molécules sont donc complètement halogénées. Seuls subsistent les atomes de carbones centraux de la molécule d'alcane dont est issu un CFC donné, liés à des atomes de chlore et de fluor. Les diverses molécules de CFCs différent par le nombre d'atomes de carbone, de chlore et de fluor qui les composent, et la disposition des atomes dans l'espace (différentes formes, dites isomères).
Tous les CFCs, à l’exception notable des composés CH3Cl et CH3Br qui peuvent être émis par les océans, sont d'origines anthropiques. Ces composés anthropiques ont été commercialisés sous l'appellation "fréon" par la société Dupont, mais deux autres nomenclature existent, l'une systématique, l'autre dérivant de la précédente et valable pour les gaz utilisés en réfrigération. Ainsi, le CCl3F, peut également être appelé fréon 11, CFC-11, ou R-11. Les cinq composés les plus utilisés sont les CFC 11 et 12 obtenus à partir du méthane, et les CFC-113, 114 et 115, obtenus à partir de l'éthane.
Les CFCs sont des composés qui sont incolores, inodores, et non corrosifs à l’état gazeux ou liquide. Ils sont de très peu coûteux à fabriquer (à partir d'alcanes, par substitution des atomes d'hydrogène par des atomes de chlore et de fluor), et ont de nombreuses propriétés physico-chimiques. Ils sont entre autres extrêmement stables et inertes, presque autant que des gaz rares, en raison de la nature des liaisons entre les différents atomes les composant. Cela leur a valu un grand intérêt de la part des industries et a expliqué l'utilisation massive qui en a été faite jusqu'à la découverte de leur rôle dans la destruction de la couche d'ozone. Ils ne sont pas intrinsèquement toxiques, bien que certains de leurs produits de décomposition puissent l'être. Les CFCs ont été utilisés comme réfrigérants à partir des années 1930, usage qui est resté prédominant dans l'utilisation de ces composés. Les CFCs sont particulièrement intéressants à utiliser dans cette application car par leur stabilité et leur absence de corrosion, l'installation réfrigérante a une longue durée de vie. De plus, les propriétés thermodynamiques (température d'ébullition modérée et chaleur de changement de phase importante, c'est-à-dire qu'un CFC absorbe beaucoup de calories par unité de masse) de ces composés font que l'efficacité énergétique des installations est optimisée, qui plus est dans des conditions de sécurité maximales (composés ininflammables et non toxiques). Ils ont été également été utilisés comme gaz propulseurs des aérosols (intérêt pour leur inertie chimique et leur vitesse d’évaporation élevée), comme matières premières dans la synthèse de composés organiques, comme solvants (nettoyage industriel), comme extincteurs, et comme agents d’expansion dans les mousses de matières plastiques.
II Les émissions
La production de CFC-11 et CFC-12 a commencé à la fin des années 30 (cf figure 1 ci-dessus), avec une utilisation principalement concentrée dans l'industrie de la réfrigération. La production (et l'injection dans l'atmosphère) de ces composés a augmenté très lentement jusqu'à l'immédiate après guerre, période où les CFCs ont commencé à être utilisés comme gaz propulseurs dans les aérosols. Très rapidement alors, l'utilisation du CFC-12 comme gaz propulseur a dépassé l'usage comme réfrigérant. A partir des années 50, l'utilisation des CFCs (-11 et-12) comme agent d'expansion dans la fabrication de mousses synthétiques devient une source additionnelle et significative de fabrication et dispersion des CFCs dans l'atmosphère. Une première interdiction de l'usage des CFCs dans les aérosols (en 1975 aux Etats-Unis) explique la décrue observée jusqu'au début des années 1980, époque ou les autres usages des CFCs augmentant, les émissions augmentent à nouveau. Le CFC-12 est resté très longtemps le réfrigérant le plus largement utilisé dans la climatisation des habitations, et encore plus longtemps dans celles des voitures. La baisse observée depuis la fin des années 1980 est directement liée au protocole de Montréal et à ces amendements successifs. Les CFCs, puis les HCFCs ayant montré leur nocivité vis-à-vis de la couche d'ozone stratosphérique, ils sont remplacés au fur et à mesure dans les différentes applications industrielles par des hydrofluorocarbures ou HFCs. Ces composés ne contenant pas de chlore, ils ont un impact très limité sur la couche d'ozone. En revanche, s'ils ne détériorent pas la couche d'ozone, les HFC favorisent l'effet de serre et font partie des six principaux gaz à effet de serre inscrits sur la liste du Protocole de Kyoto. Leur potentiel de réchauffement global* (PRG calculé à 100 ans) correspond en moyenne à 2 800 fois celui du CO2, avec des valeurs comprises entre 140 (HFC-152a) et 11 700 (HFC-23). Ces fortes valeurs de potentiel de réchauffement global sont notamment dues à une grande durée de vie dans l’atmosphère (jusqu'à 264 ans pour le HFC-23). Accessoirement, en plus de protéger l’ozone, il se trouve que les HFC offrent une bien meilleure efficacité énergétique que les CFCs. Les HFCs possèdent des propriétés techniques similaires à celles des CFCs, notamment leur ininflammabilité, leur faible toxicité ainsi que leur température de fusion permettant de les utiliser comme fluides réfrigérants. Les HFCs peuvent donc facilement remplacer les CFCs dans la majorité de leurs applications, tout en réduisant la quantité de gaz nécessaire. On estime que les HFCs contribuent aujourd’hui à environ 0,5-1 % de l’effet de serre global et que cette contribution devrait atteindre environ 3 % en 2050. En effet, les émissions de HFCs sont en hausse depuis les années 1990 (+208 % de 1990 à 2004 en France), mais l'impact sur le climat reste beaucoup moins alarmant que celui des CFCs qui représentait 25 % des contributions à l’effet de serre global additionnel en 1990. L’utilisation des HFC demeure encore avantageuse sur le plan énergétique et pour l’environnement, mais les émissions de ces composés sont aujourd’hui contrôlées et une attention est portée afin de réduire celle-ci autant que faire se peut. En l'absence d'alternative viable d'un point de vue économique, ces gaz seront sans doute encore utilisés dans l’industrie du froid pour quelques années ou décennies.
III Effets des CFCs sur la chimie de l'atmosphère
En raison de leur grande stabilité (durée de vie que quelques dizaines d'années à plus d'un siècle), les CFCs sont susceptibles d'atteindre la stratosphère où ils peuvent se dissocier pour former des atomes de chlore qui participeront à la destruction catalytique de l'ozone (cf. fiche O3 strato).
Les CFCs sont responsables de la dégradation de l’ozone stratosphérique et sont à ce titre sont regroupés sous l'appellation Substances Apprauvissantes en Ozone (SAO). La mise en évidence au début des années 1980 de déficits saisonniers importants et anormaux de la colonne d’ozone au-dessus des pôles a conduit, dès 1985, à la signature de la convention de Vienne pour la protection de la couche d’ozone. Cette convention encourageait les travaux de recherche, la coopération et l’échange d’information entre les états, ainsi que des mesures législatives nationales, sans pour autant exiger de mesures concrètes en matière de limitation des émissions de chlorofluorocarbures et autres substances halogénées destructrices de l’ozone stratosphérique. Cette convention a été suivie en 1987 par le protocole de Montréal qui, en revanche, a imposé un calendrier et des objectifs d’arrêt de la production et de la commercialisation d’une première liste de substances (chlorofluorocarbures). A la lumière des évaluations scientifiques sur la baisse de l’ozone et de ses cause, ce protocole a été successivement amendé et modifié à diverses reprises en 1990 à Londres, en 1992 à Copenhague, en 1995 à Vienne, en 1997 à Montréal et en 1999 à Pékin, en vue de parvenir à une restauration de la couche d’ozone sur une période de 50 ans. Ces divers amendements ont progressivement durci les échéanciers de fin de production et d’utilisation des substances concernées, et élargi la liste initiale des substances en l’étendant notamment aux halons, hydrochlorofluorocarbures (HCFC), et au tétrachlorure de carbone. En Europe, depuis le 1er octobre 2000, les CFCs ne peuvent plus être mis sur le marché et doivent être impérativement récupérés et détruits depuis le 1er janvier 2002 (DEEE).
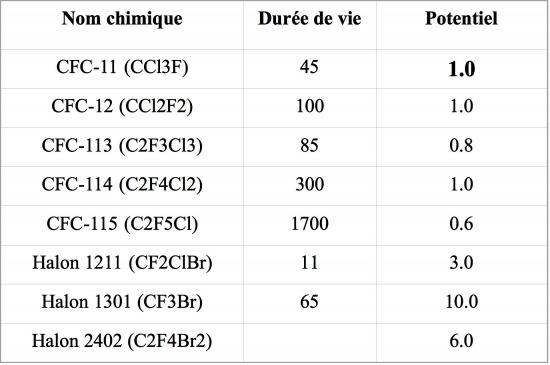
Le potentiel de destruction de l’ozone (PDO) exprime le changement de quantité d’ozone stratosphérique susceptible de découler de l’émission d’une certaine masse de composés halogénés, par rapport au changement résultant de l’émission de la même masse de CFC-11 pris comme référence (PDO égal à 1, cf. tableau 1 ci-dessous). Ces indices, calculés par modélisation, prennent en compte la durée de vie des espèces dans l’atmosphère (qui comme on le voit dans le tableau, est fortement variable, entre 11 et 1700 ans dans les exemples donnés), et sont annexés aux accords et protocoles qui découlent de la convention de Vienne. Cependant, les calculs de PDO sont entaché d’incertitudes qui sont d'une part liées à la connaissance incomplète de l’ensemble des processus de dégradation de la couche d’ozone, d'autres part, aux incertitudes sur les concentrations d’espèces traces telles que le radical OH, qui interviennent dans la chimie de l’ozone.
Tableau 1: durées de vie et potentiels de destruction de l’ozone (PDO) des CFCs et halons les plus courants
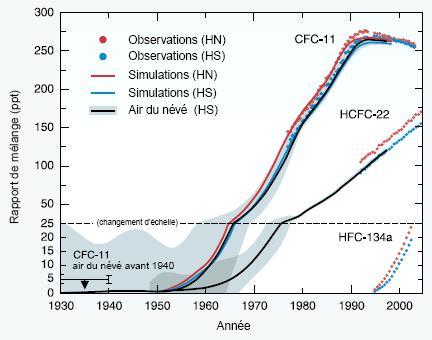
Les dernières mesures ont montré une diminution du taux d'appauvrissement de l'ozone dans la stratosphère et les premiers signes de sa reconstitution au-dessus de l'Arctique et de l'Antarctique, ainsi qu'aux latitudes moyennes des deux hémisphères. Cependant, la couche d'ozone reste appauvrie et, selon les scientifiques, elle restera généralement vulnérable au cours des dix prochaines années environ. Cette vulnérabilité ne serait plus tant liée aux concentrations de CFCs dans l'atmosphère, qu'à l'augmentation des concentrations de CH4, N2O et NOx dans la stratosphère, tous gaz pouvant jouer un rôle dans la destruction de l'ozone dans cette couche de l'atmosphère.
Les CFCs ont été remplacés par les HCFCs qui ont un impact moins important, bien que non négligeable, sur la destruction de l'ozone stratosphérique, et qui sont de puissants gaz à effet de serre. Si l'impact des ces gaz sur l'ozone stratosphérique est moindre, c'est notamment parce que leur durée de vie est beaucoup plus courte, notamment à cause d'un plus grand taux de photolyse dans la troposphère, ce qui fqit qu'une faible faction de ces composés est susceptible d'atteindre la stratosphère. Le HCFC-22 est le plus abondant de sa famille avec une concentration actuelle de 160 ppt. La concentration de ce composé a commencé à augmenter au début des années 70, à l’instar de celle des CFC, alors que les concentrations des autres HCFC notables n’ont débuté leur progression (+3-7%) que dans les années 90, comme celles des HFC.
En raison de leur non innocuité vis-à-vis de la couche d'ozone et du climat, le protocole de Copenhague appelle à leur interdiction d'ici 2030 pour les pays industrialisés et 2040 pour les pays en développement.
IV Effets des CFCs sur le climat
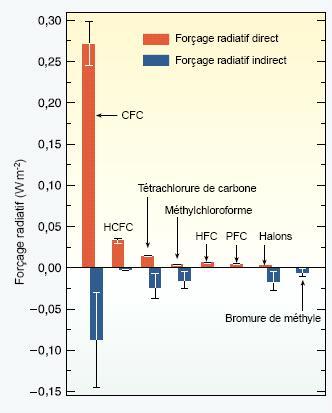
De nombreux halocarbures, dont les CFCs, PFCs, HFCs et HCFCs, sont des GES effectifs car ils absorbent les rayons infrarouges émis depuis le sol dans un domaine spectral où l’énergie n’est pas retirée par le CO2 ou la vapeur d’eau ('fenêtre atmosphérique*'). Les molécules d’halocarbures peuvent être des milliers de fois plus efficaces (en terme de pouvoir de réchauffement global ou PRG*, grandeur intégrant à la fois la durée de vie du composé dans l'atmosphère, et l'efficacité de piégeage du CO2 par chacune des molécules atmosphériques considérée) pour absorber l’énergie radiative émise depuis la Terre qu’une molécule de CO2. Ainsi, un faible volume de ces gaz peut contribuer de manière notable au forçage radiatif du système climatique. Le premier effet radiatif du CO2 et de la vapeur d’eau est de réchauffer le climat de surface tout en refroidissant la stratosphère. Compte tenu de leur absorption dans la fenêtre atmosphérique, l’effet radiatif direct des halocarbures est de réchauffer à la fois la troposphère et la stratosphère. Outre leur effet direct sur le climat, certains gaz ont un effet indirect, soit dû au forçage radiatif causé par leurs produits de dégradation, soit de par leur influence sur la chimie de l’atmosphère. On l'a dit, les halocarbures contenant du chlore ou du brome sont des substances menaçant la couche d'ozone (SAO). Or l’ozone est un gros absorbeur de rayons UV, ils ont donc un effet de refroidissement indirect non négligeable (par destruction de O3) par rapport à leur effet de réchauffement direct. D'après le dernier rapport du GIEC*, le forçage radiatif positif direct des CFCs serait de l'ordre de +0,35 ± 0,03 W m–2 entre 1750 et 2000 (cf. figure ci-dessous). Ce forçage représenterait 13 % du forçage radiatif total imputable à la hausse des concentrations de mélange homogène de tous les gaz à effet de serre pendant la même période. Toujours d'après le GIEC, le forçage radiatif négatif indirect actuel des CFCs, par destruction de l'ozone stratosphérique, serait égal à –0,05 ± 0,10 W m–2, toujours sur la période allant de 1750 à 2000. Il faut préciser qu'une grande incertitude est associée à cette dernière estimation. En effet, le forçage radiatif de l'ozone est fortement dépendant de la répartition verticale de ce gaz dans l'atmosphère. En absence d'une connaissance parfaite de cette répartition à l'échelle globale, et de la déperdition de l'ozone liée aux CFCs sur cette même répartition verticale, il est difficile d'extrapoler les résultats à l'échelle globale. On remarquera de plus que si le réchauffement lié à la présence des halocarbures est global (composés répartis à la surface du globe), la perte d'ozone à un cycle saisonnier (printemps) et est essentiellement (mais pas uniquement) observée aux niveaux des pôles. On a donc deux mécanismes distincts qui ont des répartitions spatiales et temporelles différentes, qui ne se compensent pas simplement l’un l’autre. Il est cependant très probable (probabilité supérieure à 90%) au final que le forçage négatif indirect soit inférieur au forçage positif direct.
Glossaire
Fenêtre atmosphérique:
Une fenêtre atmosphérique est une partie du spectre électromagnétique pour laquelle l'absorption par l'atmosphère de la Terre est minimale. On parle abusivement d'une fenêtre atmosphérique, alors que dans le domaine optique, il y a plusieurs domaines dans lesquels l'atmosphère est relativement transparente aux rayons solaires. En effet, l'atmosphère est transparente au rayonnement visible, mais lorsque l'on fait allusion à la "fenêtre atmosphérique, on parle en générale des deux fenêtres principales qui se situent dans l'infrarouge, entre 3 et 5 µm et 8 et 14 µm environ.
PRG (Pouvoir de Réchauffement Global):
Le pouvoir de réchauffement global (PRG) d'un gaz se définit comme le forçage radiatif (c'est à dire la puissance radiative que le gaz à effet de serre renvoie vers le sol), cumulé sur une durée qui doit être définie, et qui en général, est prise comme égale à 100 ans. Cette valeur se calcule relativement au CO2 pris comme gaz à effet de serre de référence. Ainsi, par définition, le PRG du CO2 est toujours égal à 1. Le PRG est un moyen simple de comparer entre eux les différents gaz à effet de serre qui influencent le système climatique. Il est utilisé pour prédire les impacts relatifs de différents gaz sur le réchauffement global en se basant sur leurs propriétés radiatives. La période (ou durée) utilisée pour le calcul du PRG doit être mentionnée, faute de quoi la valeur donnée est dépourvue de sens.
GIEC (Groupe Intergouvernemental pour l'Etude du Climat ou Intergovernmental panel on climate change- IPCC en anglais): le GIEC a été créé en 1988 par l’Organisation météorologique mondiale (OMM) et le Programme des Nations Unies pour l’environnement (PNUE), tous deux conscients du problème que pourrait poser le changement climatique à l’échelle du globe. Ses missions sont d'évaluer, sans parti pris et de façon méthodique claire et objective, les informations d'ordre scientifique, technique et socio-économique nécessaires pour évaluer les fondements scientifiques des risques liés au changement climatique d’origine humaine, les conséquences possibles de ce changement, et d'envisager d’éventuelles stratégies d’adaptation et d’atténuation. Le GIEC n'a pas de mandat pour entreprendre des travaux de recherche, ni pour suivre l’évolution des variables climatologiques et d’autres paramètres pertinents. Les évaluations du GIEC sont ainsi principalement fondées sur les publications scientifiques et techniques de valeur scientifique reconnue. La principale activité du GIEC consiste donc à évaluer à intervalle régulier de l’état des connaissances relatives au changement climatique en publiant des rapports (4 depuis 1988, le dernier en 2007).