Polluants
N2O – Protoxyde d'azote
En raison de l’apparition de sources d’origine humaine, la concentration de N2O a commencé à augmenter au début du 20° siècle, et l’augmentation s’est fortement accélérée depuis les années 1950 avec le développement de l’agriculture industrielle et le recours massif aux engrais azotés. En 2010, la concentration de N2O est supérieure à 320 ppbv, son taux actuel d’augmentation est d’environ 0,8 ppbv/an, soit 0,25% par an.
Le protoxyde d'azote ou oxyde nitreux (N2O) est stable (durée de vie de 150ans) dans la troposphère car il n'est pas détruit par photolyse dans la troposphère. Il ne peut donc être détruit que dans la stratosphère, où il se transforme en oxydes d’azote, qui vont intervenir ensuite dans les cycles catalytiques de destruction de l’ozone.
Le N2O est un gaz à effet de serre particulièrement efficace en raison de sa capacité d’absorption du rayonnement infra-rouge. Une molécule de N2O a une capacité d’absorption 200 fois plus importante qu’une molécule de CO2 (PRG calculé à 100ans). Actuellement le N2O représente, en équivalent CO2, 7,9 % des émissions des gaz à effet de serre contribuant à l’effet de serre additionnel. Globalement l’augmentation du N2O est responsable de 4% de l’effet de serre additionnel observé depuis le début de l’ère industrielle.
I - Introduction
Le protoxyde d'azote (N2O), aussi appelé oxyde nitreux, a des propriétés euphorisantes (gaz hilarant). Il a de nombreuses utilisations, aussi bien en anesthésie, que comme oxydant dans certains moteurs- fusées et autres applications. Ce composé est stable dans la troposphère car sa destruction par photolyse intervient à des longueurs d’ondes inférieures à 400 nm. Il n’est donc détruit que dans la stratosphère, où il peut donner des oxydes d’azote qui interviennent ensuite dans les cycles catalytiques de destruction de l’ozone. L’autre impact important du N2O est son rôle en tant que gaz à effet de serre. Le protoxyde d’azote est issu principalement de réactions biologiques qui accompagnent le cycle de l’azote dans la biosphère continentale ou océanique (réaction de dénitrification en anoxie).
II - Sources et puits de N2O
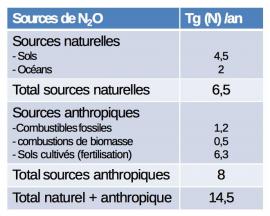
Le N2O est émis naturellement dans l’atmosphère, mais sa production dans les sols est fortement augmentée par la fertilisation azotée. Les sources naturelles de N2O représentent 6,5 Tg (millions de tonnes) par an d’azote sous forme de N2O, la source principale étant les sols et dans une moindre mesure l’océan (cf. tableau1). Les sources d’origine humaine sont actuellement largement supérieures aux sources naturelles. Ces sources sont les combustions de combustibles fossiles ou de biomasse, mais surtout l’utilisation d’engrais azotés. La sur-fertilisation injecte dans le sol des nitrates qui ne sont pas assimilés par la végétation. Dans les zones peu oxygénées (zones humides), l’excès de nitrates est dénitrifié, et une partie est transformée en N2O qui est émis dans l’atmosphère, où le seul puits connu est la lente photolyse* dans la stratosphère.
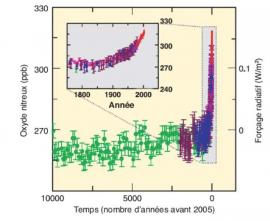
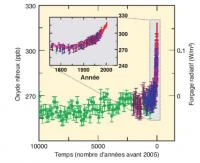
En raison de sa stabilité dans la basse atmosphère, la concentration de fond naturelle du protoxyde d’azote est élevée (270 ppbv) et uniforme dans toute la troposphère. La stabilité du N2O a permis l’analyse de sa concentration dans les inclusions d’air des calottes polaires. Cette concentration est restée stable sur les dix mille dernières années, où l’on a observé aussi une relative stabilité de la température moyenne. En raison de l’apparition de sources d’origine humaine, la concentration de N2O a commencé à augmenter au début du 20° siècle, augmentation qui s’est fortement accélérée depuis les années 1950 avec le développement de l’agriculture industrielle et le recours massif aux engrais azotés de synthèse. En 2010, la concentration de N2O est supérieure à 320 ppbv, son taux actuel d’augmentation est d’environ 0,8 ppbv/an, soit 0,25% par an (figure 1).
III - Rôle du N2O dans l’atmosphère
III-1. Impact sur la couche d’ozone stratosphérique
L’importance des oxydes d’azote NOx dans l’équilibre de l’ozone à l’échelle globale a été mise en évidence au début des années 1970 par Johnston et Crutzen (prix Nobel de chimie en 1995). La principale source de NOx stratosphérique est effectivement le N2O émis au niveau du sol par des processus biologiques ou liés aux activités humaines. Sa durée de vie dans la basse atmosphère est de l’ordre de 150 ans, ce qui lui permet d’atteindre la stratosphère où il est :
-soit photodissocié :
N2O+hν JN2O N2 +O1D R-1 ␣␣␣␣
-soit détruit par réaction avec l’atome d’oxygène excité O1D :
N2O+O1D
→ N2 +O2 R-2
→ NO + NO R-3
La réaction R-3 représente moins de 5 % de la perte totale de N2O dans la stratosphère. Des trois mécanismes ci-dessus, c’est cependant le seul qui conduit à la formation de radicaux azotés actifs, sous la forme de monoxyde d’azote (NO), qui peut ensuite détruire l’ozone selon cycle catalytique suivant:
NO+O3 →NO2 +O2
NO2 + O → NO + O2
bilan:O3+O →2O2
Ce cycle intervient surtout dans moyenne stratosphère. Il en fait plus complexe car le NO2 formé peut aussi se photolyser pour redonner du NO, ou bien réagir avec des espèces chlorées (voit fiche chimie hétérogène).
III-2. Le N2O : gaz à effet de serre
Le N2O est un gaz à effet de serre particulièrement efficace en raison de sa capacité d’absorption du rayonnement infra-rouge. Une molécule de N2O a une capacité d’absorption 200 fois plus importante qu’une molécule de CO2 (PRG* calculé à 100ans). Comme son temps de séjour dans l’atmosphère est comparable à celui du CO2, son efficacité d’absorption relativement au CO2, caractérisée par le potentiel de réchauffement global (PRG*) ne décroît pas avec le temps (voir fiche effet de serre). Actuellement le N2O représente, en équivalent CO2, 7,9 % des émissions des gaz à effet de serre contribuant à l’effet de serre additionnel. Globalement l’augmentation du N2O est responsable de 4% de l’effet de serre additionnel observé depuis le début de l’ère industrielle.