Compléments
Les techniques de mesure (général)
I Introduction
L’atmosphère est un milieu gazeux dilué dans lequel le di-azote et le di-oxygène sont les composés majoritaires (78.08 et 20.95 % respectivement). Les composés d’intérêt pour l’étude de l’évolution du climat, de la chimie atmosphérique ou de l’impact sur la santé sont en concentrations beaucoup plus faibles que N2 et O2 et nécessitent donc des techniques analytiques très sensibles pour être mesurés. Le nombre important de composés présents impose de plus que les mesures soient spécifiques et l’inhomogénéité de l’atmosphère liée à la proximité de sources, à la dilution par le mélange ou à leur réactivité nécessite de pouvoir mesurer ces espèces sur de grandes plages de concentration (plusieurs ordres de grandeur). La sensibilité de la détection est également un paramètre essentiel de ces techniques de mesure ; elle sera d’autant plus grande que le rapport du signal du détecteur en présence d’un composé d’intérêt sur le bruit obtenu « à vide » sera le plus grand.
II Les techniques spectroscopiques
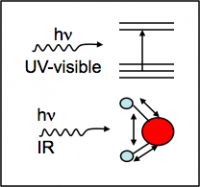
Les techniques spectroscopiques sont utilisées pour déterminer la composition chimique et la structure de molécules. En effet, chaque molécule peut être caractérisée par sa structure interne (niveaux électroniques, interactions atome/atome, angles et longueurs de liaisons, …) qui donne lieu à des transitions électroniques (rayonnement UV-visible) ou des mouvements de vibration-élongation des atomes (rayonnements IR), par absorption d’énergie (figure 1). L’énergie E, apportée sous forme de rayonnement électromagnétique, est proportionnelle à la longueur d’onde λ de ce rayonnement par la relation :
E = h.ν = h.c/λ avec
- E énergie du rayonnement incident
- h constante de Planck (6,626.10-34 J.s)
- ν et λ : fréquence (s-1) et longueur d’onde (m) du rayonnement
- c : vitesse de la lumière (3.108 m.s-1)
L’interprétation de la proportion de rayonnement absorbée par la molécule en fonction de la longueur d’onde émise donne des informations sur le composé présent et sa quantité. L’atténuation du rayonnement, quantifiée par la loi de Beer-Lambert, est donc spécifique du(des) composé(s) à la température et la pression de mesure et de sa(leur) concentration :
A = log I0/I
= ε.L.C = σ.L.Cm avec
- A absorbance du rayonnement par la molécule considérée
- I0 et I intensités du rayonnement incident et transmis
- ε et σ coefficient d’extinction molaire (L.mol-1.cm-1) et section efficace (cm2.molécule-1) de la molécule (efficacité d’absorption du rayonnement par la molécule)
- L : longueur du trajet optique parcouru par le faisceau (cm)
- C et Cm concentration molaire (mol.L-1) et moléculaire (molécules.cm-3) de la molécule.
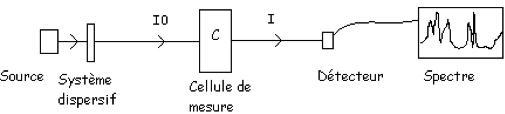
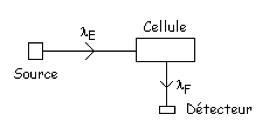
Les mesures d’absorption (figure 2) sont réalisées sur un trajet optique limité par un émetteur (source lumineuse) et un récepteur (détecteur) ou par la longueur de la cellule de mesure dans laquelle est placé l’échantillon. Un système optique ou mécanique (système dispersif) permet la décomposition, si nécessaire, du faisceau incident en longueurs d’onde discrètes (spectre d’émission) ou l’obtention de sources de longueurs d’onde données (filtre optique, …). La détection du signal est réalisée à l’aide d’un photomultiplicateur éventuellement couplé à un filtre optique, ou de photodiodes spécifiques à des longueurs d’onde données. La variation du signal avec la longueur d’onde donne un spectre (A = f(λ)), dont le traitement parfois complexe peut-être réalisé par traitement mathématique.
Le système peut être à simple (figure 2) ou à double faisceau ; dans ce dernier cas, le 1er faisceau passe dans une cellule référence ne contenant pas le composé, mais étant identique à la cellule de mesure. Ceci permet de déterminer l’absorbance liée au système de mesure propre (cellule, miroirs, …). La mesure de l’intensité lumineuse est donc réalisée en alternance sur les 2 faisceaux, soit par un seul détecteur soit avec 2 détecteurs identiques, et l’absorbance du composé est déduite.
II.1 Absorption UV-visible
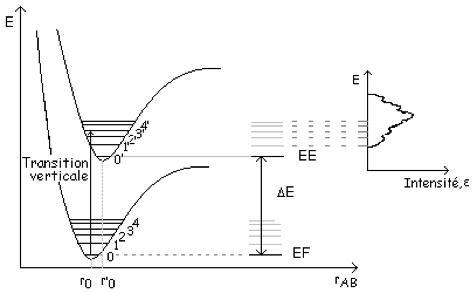
En spectroscopie UV/visible (λ : 200-400/400-800 nm), l’énergie absorbée, notée ΔE, correspond à des transitions entre niveaux électroniques de la molécule. Les niveaux électroniques sont discrets et correspondent aux valeurs d’énergie potentielles des électrons dans les orbitales moléculaires. Les molécules sont en général dans l’état d’énergie le plus faible appelé état fondamental, EEF, correspondant aux niveaux d’énergie les plus faibles pour les électrons de valence. L’absorption d’énergie conduit ces électrons à des niveaux d’énergie supérieure, EEE, appelés états excités. L’énergie absorbée est alors ΔE = EEE – EEF. Or, un état électronique d’une molécule est perturbé par les mouvements des atomes qui la constituent. Chaque état électronique comporte donc des niveaux vibrationnels d’énergie quantifiée (v = 0, 1, 2, …). De même, chaque niveau de vibration est sub-divisé en sous niveaux d’énergie de rotation de la molécule. La figure 3 représente le schéma de l’énergie potentielle de l’état fondamental et d’un état excité d’une molécule diatomique en fonction de la distance rAB entre les 2 atomes. Le principe de Franck-Condom stipule que, à température ordinaire, lors d’une transition électronique quasi-instantanée, les positions relatives des atomes restent inchangées, la transition est dite verticale. Les minima des courbes d’énergie potentielle étant décalés, une transition verticale à partir d’un niveau vibrationnel vEF = 0 conduira à un niveau vibrationnel différent à l’état excité de celui de l’état fondamental (Δv ≠ 0 et vEE > 0).
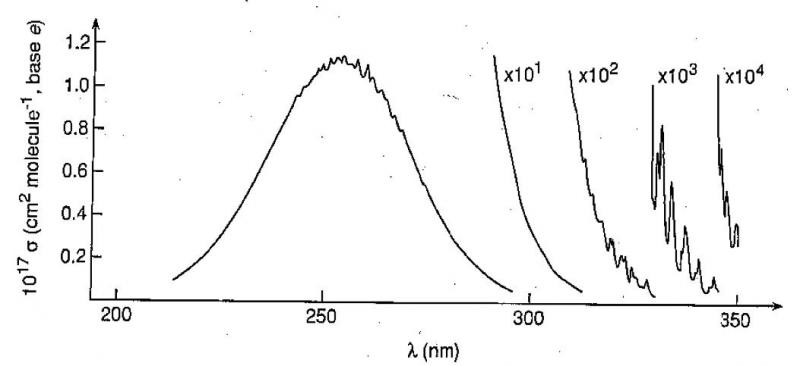
A l’état liquide en fonction du solvant utilisé, la liberté de mouvement des molécules est amoindrie ; on observe généralement une bande d’absorption large centrée sur le maximum de probabilité de transition électronique (εmax). A l’état gazeux, peu concentré, des bandes d’absorption plus fines apparaissent correspondant aux transitions entre niveaux vibrationnels de niveaux électroniques différents (exemple du spectre d’absorption de O3 dans l’UV : Figure 4).
Pour faire des mesures en spectroscopie d’absorption UV « classique », la source est constituée de 2 lampes présentant un spectre d’émission continu sur toute la plage de longueur d’onde (190-1100 nm). Une fois le spectre obtenu, la mesure de la concentration est réalisée en général à un maximum d’absorption du composé, si celui-ci n’est pas masqué par l’absorption d’un autre composé ou par celle du solvant (liquide ou gazeux). Pour des instrumentations spécifiques à la mesure d’un composé, une source lumineuse présentant une raie d’émission coïncidant avec un maxima d’absorption du composé recherché est privilégiée (exemple : lampe à vapeur de mercure pour la mesure de l’ozone). A l’état gazeux, la spectroscopie d’absorption peut être réalisée en dessous de 200 nm (UV lointain), à condition d’éliminer le di-azote et le di-oxygène du système car ils absorbent fortement à ces longueurs d’onde ; on parle alors de spectroscopie du vide.
II.2 Emission UV : fluorescence, chimioluminescence
Lorsqu’une molécule est dans un état électronique excité, noté *, elle a tendance à redescendre dans un état de moindre énergie. Cette perte d’énergie pour la molécule peut se faire, entre autres, par choc avec d’autres molécules ou par émission de photons, c’est la luminescence. Si l’énergie initiale a été apportée par un rayonnement électromagnétique, c'est-à-dire des photons, on parle alors de fluorescence (associée à une décroissance rapide de l’intensité dans le temps, transition entre états électroniques de même spin), ou de phosphorescence (associée à une décroissance lente de l’intensité dans le temps, transition entre états électroniques de spins différents). Si l’état excité est obtenu par une réaction chimique, on parle de chimioluminescence. La mesure réalisée est dans, tous les cas, celle des photons spécifiques émis lors du retour à un état de plus faible énergie. La spécificité de ce type de mesure est grande car initiée par le mode d’excitation qui est caractéristique de la molécule recherchée et la longueur d’onde du rayonnement émis.
Un balayage en longueur d’onde du faisceau incident permet d’obtenir le spectre de fluorescence. En analyse quantitative, on utilise une longueur d’onde, dite excitatrice λE, de la molécule, la mesure est réalisée à une longueur d’onde de fluorescence, λF >= λE, correspondant à une variation d’énergie égale ou plus faible que l’apport initial. En effet, le niveau vibrationnel de l’état excité avant émission est en général le fondamental (v = 0) de l’état électronique excité donc plus bas que celui obtenu à l’excitation (v > 0). Le spectre d’émission est donc en général décalé vers les grandes longueurs d’onde.
L’émission du rayonnement de luminescence se fait statistiquement dans toutes les directions. Ceci est utilisé pour la mesure en fluorescence, pour laquelle la détection est réalisée à 90° du rayonnement incident (figure 5) afin d’optimiser la mesure sans saturer le détecteur avec le rayonnement incident.
Dans le cas de la chimioluminescence, une réaction chimique particulière est générée dans la cellule en apportant un réactif spécifique du composé à mesurer (i) en phase gazeuse (exemples de la mesure de l’ozone [O3] avec l’acétylène [C2H2] ou du monoxyde d’azote [NO] avec l’ozone) ou (ii) à l’interface liquide/gaz (exemple de la mesure du dioxyde d’azote [NO2] avec le luminol). A l’état gazeux, le retour à l’état fondamental par luminescence est favorisé en limitant les chocs entre molécules (quenching) en abaissant la pression dans la cellule de mesure.
II.3 Absorption IR
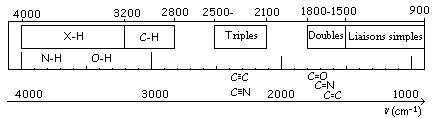
Le spectre Infra-Rouge (IR) couvre les longueurs d’onde de 1000 à 0,8 μm (10 - 14000 cm-1). La mesure par spectroscopie IR est généralement limitée à la zone de l’infrarouge moyen correspondant à des longueurs d’onde entre 30 et 1,4 μm (400-4000 cm-1) qui permet d’avoir des informations sur les groupements constitutifs de la molécule. En effet, l’énergie absorbée par la molécule dans cette région permet aux atomes de vibrer autour de leurs positions d’équilibre, ce qui induit des variations des longueurs de liaison et des variations d’angle de liaison caractéristiques des groupements constitutifs (figure 6).
Les mesures infrarouges sont ainsi largement utilisées pour les études environnementales, pour l’identification des composés présents (études cinétiques en chambre de simulation) ou pour la mesure de composés particuliers. L’utilisation de cellules avec multi réflexion à l’aide de miroirs permet d’améliorer la sensibilité des systèmes de mesure ; le nombre de réflexions est un compromis entre augmentation de l’absorption par les composés d’intérêt et atténuation de l’intensité par la perte sur les miroirs.
II.4 Mesures IR par transformées de Fourrier
Les mesures infrarouges sont réalisées avec un rayonnement incident dit thermique. Le spectre d’absorption « classique » peut être obtenu par balayage des longueurs d’ondes de la source dispersées par un monochromateur. Cette technique relativement lente a été remplacée par l’utilisation d’un interféromètre de Michelson (Fiche C3). L’interférogramme obtenu en quelques secondes subit un traitement mathématique par transformées de Fourrier pour l’obtention du spectre correspondant.
II.5 Autres mesures IR : NDIR, TDLS
La spectroscopie IR non dispersive (NDIR) est également utilisée pour la mesure d’un composé donné. La technique est dite par corrélation : elle est basée sur l’utilisation d’une source lumineuse limitée par un filtre centrée sur l’absorbance de la molécule considérée. Le faisceau passe alternativement (à grande vitesse) (i) sur une cellule contenant le composé à forte concentration pour éliminer toutes les radiations le concernant et déduire l’absorption des autres composés, puis (ii) sur une cellule contenant l’échantillon et (iii) sur une cellule contenant le solvant. A condition que l’absorption des autres composés soit faible sur la plage de longueurs d’onde caractéristiques du composé, l’absorption déduite est spécifique à ce dernier (exemple de la mesure de CO, fiche C2).
La spectroscopie par diode laser accordable (TDLS) utilise des longueurs d’onde présélectionnées en mettant en œuvre des diodes dont l’émission est centrée sur ces longueurs d’onde. L’effet de la température sur la longueur d’onde émise par chaque diode permet d’affiner la spécificité de ce type de mesure. Toutefois, la complexité technique fait qu’un faible nombre de composés peut être mesuré simultanément.
III Les techniques d’analyse chromatographique
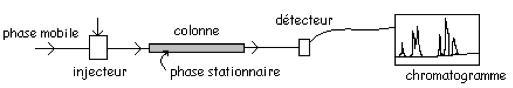
Pour mesurer la concentration d’un composé particulier, il peut être nécessaire de le séparer d’autres composés ayant des caractéristiques analytiques identiques : les techniques chromatographiques sont alors utilisées. L’échantillon est injecté (figure 7) dans une colonne contenant une phase stationnaire avec laquelle les composés auront plus ou moins d’interaction. Un fluide vecteur (gazeux ou liquide), la phase mobile, permet l’entraînement différentié des composés dans la colonne et leur séparation avant leur détection. La phase stationnaire peut être solide ou liquide. La séparation des composés est réalisée sur la base de processus d’adsorption, de solubilisation, sur des différences de polarité ou de charge électrique des composés et des phases mobile et stationnaire. La détection est réalisée par un système spécifique et sensible à la famille de composés analysés.
Le chromatogramme obtenu correspond à la variation de signal du détecteur au passage de chaque composé dans son corps. Une bonne analyse conduira à une série de pics de forme gaussienne et bien résolus dans le temps. L’étape d’injection doit être très brève pour que les pics soient fins et bien définis au dessus de la ligne de base. Les composés sont identifiés par leur temps de rétention : temps entre le moment d’injection et le maximum du signal correspondant au composé.
III.1 Techniques d’analyse par chromatographique liquide : HPLC, CI
Les techniques de chromatographie liquide sont basées sur l’entraînement des composés par un liquide : un solvant organique pour la chromatographie liquide haute performance (HPLC) et un solvant aqueux pour la chromatographie ionique (CI). Les composés sont donc en solution organique ou aqueuse.
En HPLC, la polarité de la phase mobile peut être ajustée pour optimiser la séparation pour une phase stationnaire donnée. Par exemple, l’hexane (C6H14) est utilisé pour l’entraînement de composés peu polaires, l’acétonitrile (CH3CN) sera privilégiée pour celui de composés plus polaires comme les composés carbonylés. L’utilisation de mélange de solvants en isocratique (composition fixe) ou en programmation de composition permet également d’ajuster la séparation des composés dans le cas de mélanges complexes. La séparation des composés est réalisée par leur rétention sur la phase stationnaire. Sa polarité peut être ajustée (en changeant de colonne) pour une série d’analyses donnée. La détection est réalisée en général par spectrométrie UV-visible, sur une longueur d’onde d’absorption maximale de la famille de composés ou du composé recherché. L’HPLC est utilisée pour la mesure de nombreux composés organiques de l’atmosphère. Son application nécessite une phase de prélèvement voire de piégeage/extraction des composés avant leur injection dans le système analytique (exemple de la mesure des composés carbonylés piégés dans une solution de dinitrophénylhydrazine [DNPH] ou de celle des polluants organiques lourds [POP] prélevés sur des échantillonneurs haut volume [HVS]).
La chromatographie ionique est utilisée pour la séparation des ions en solution aqueuse. La phase stationnaire est constituée de résines échangeuses d’ions alors que la phase mobile est une solution aqueuse acide ou basique en fonction que l’on veut séparer respectivement des cations ou des anions. La détection est réalisée par une mesure de conductimétrie de la solution au cours du temps. Une cellule intégrée sur le circuit (avant le détecteur) permet éventuellement d’abaisser le signal de base du détecteur en remplaçant les contre ions du solvant par des ions moins conducteurs. La CI est utilisée pour la mesure des composés dissous en phase aqueuse, soit directement (échantillons de pluie), soit après un prélèvement par piégeage dans une solution aqueuse (HNO3, HCl, HNO2), soit par piégeage sur support puis transfert en solution (NO2).
III.2 Technique d’analyse par chromatographique gazeuse : CPG
La chromatographie en phase gazeuse utilise une phase mobile gazeuse. Ceci implique que les composés analysés sont volatils ou volatilisables par élévation de température de l’injecteur. Le principe de séparation est le même que en HPLC, à savoir une rétention des composés par absorption dans une phase stationnaire liquide plus ou moins polaire ou par adsorption sur une phase solide. La phase mobile étant neutre (N2, H2, He), on ne peut jouer sur sa polarité pour affiner la séparation : une série d’augmentations de température et de paliers est en général imposée à la colonne pour faire varier la volatilité des composés et favoriser leur entraînement vers le détecteur. Pour les composés organiques, la détection est très souvent réalisée par un détecteur à ionisation de flamme (FID). Son avantage principal est que l’on peut déterminer à priori les coefficients de réponse du détecteur sur la base de la réponse de quelques composés. Par exemple, sa réponse aux hydrocarbures est directement proportionnelle au nombre d’atomes de carbone du composé détecté. La mesure du CO2 peut également être réalisée avec ce type de détecteur après une étape de réduction (méthanisation). La détection par capture d’électron (ECD) est utilisée pour la mesure de composés ayant un « excès » d’électron, tel que le protoxyde d’azote (N2O).
III.3 Détection par spectrométrie de masse : HPLC, CPG
La détection par spectrométrie de masse est de plus en plus utilisée en CPG et en HPLC. Elle permet en effet la quantification mais également l’identification des composés élués. En sortie de colonne les composés sont ionisés soit par bombardement électronique soit chimiquement. Cette ionisation conduit à la formation d’ions fragments caractéristiques de la molécule. Les ions sont focalisés puis séparés en fonction de leur masse par un champ électromagnétique ou électrostatique. La détection est ensuite réalisée en fonction des rapports m/z (masse sur charge) de chaque ion. A chaque pas de temps, l’information de l’intensité du signal de chacun des ions et le courant total sont obtenus. Pour un fonctionnement donné, l’intensité relative de ces signaux est fonction de la composition de la molécule. La comparaison de ces intensités relatives à des banques de données constituées dans les mêmes conditions permet d’aider à la reconstitution de la molécule. La séparation des fragments est réalisée par un filtre de masse quadrupolaire, des instruments à temps de vol (TOF) ou des trappes ioniques. La détection est généralement réalisée par un multiplicateur d’électrons
III.4 Autres techniques analytiques: électrochimie
D’autres techniques peuvent être utilisées, basées sur leur sensibilité, leur spécificité vis-à-vis d’un composé particulier ou sur leur portabilité. Les techniques chimiques en solution tendent à disparaître au profit d’instrumentation plus automatique. L’électrochimie est cependant encore utilisée pour la mesure de l’ozone pour réaliser des profils verticaux in situ sous ballon.
Le capteur d’ozone est alors une cellule électrochimique. Elle est constituée de 2 électrodes (cathode et anode) placées dans 2 chambres contenant une solution d’iodure de potassium à différentes concentrations. Un pont électrolytique connecte les 2 chambres. L’air contenant l’ozone est pompé à travers la chambre de la cathode. Une réaction électrochimique a lieu et la concentration de l’ozone peut être calculée.
IV Les techniques de calibration
Les techniques de calibration sont une part importante de l’analyse d’échantillons. Elles consistent à préparer des échantillons de concentration connue, des étalons, pour le composé d’intérêt afin de contrôler le signal correspondant. L’étalon est obtenu par dilutions successives du composé pur ou concentré par un solvant adéquat. L’obtention de droites d’étalonnage est recherchée dans la plage de concentration des mesures attendues. Les méthodes de calibration comprennent en général un étalonnage de l’analyseur, et une évaluation de la chaîne complète de mesure.
L’analyse de composés atmosphériques peut nécessiter la préparation de mélanges gazeux dans la plage de concentration attendue. La première étape consiste à vérifier le zéro de l’instrument en utilisant de l’air exempt du composé à mesurer. Cet air « zéro » est ensuite utilisé pour la dilution des étalons. Ces étalons sont obtenus à partir du composé pur liquide (vaporisation, diffusion, perméation) ou gazeux ou d’un étalon gazeux concentré, dilués dans l’air zéro. La dilution est réalisée par une méthode statique pour la génération d’un volume donné d’étalon ou par une méthode dynamique par contrôle des débits pour la génération d’un flux d’air de concentration donnée.
V Complément sur les mesures de gaz et de particules
| Principaux polluants | Principales méthodes de mesure (1) | Valeurs limites de qualité de l’air (2) OQ = Objectif Qualité SA = Seuil d'Alerte VLPS = Valeur Limite pour la Protection de la Santé |
| SO2 | Indice de pollution gazeuse acide. Titrimétrie. Acidité forte (automatisé / séquentiel) Photométrie de flamme Fluorescence UV DOAS LIDAR | OQ = 50 µg/m3 (1 an) SA = 500 µg/m3 (1 h) VLPS = 350 µg/m3 (moyenne horaire) |
| NO2 | Colorimétrie (Griess-Saltzman) Piégeage sur filtre imprégné à triéthanolamine Tubes à diffusion Chimiluminescence ozone Chimiluminescence Luminol DOAS LIDAR | OQ = 40 µg/m3 (1 an) SA = 400 µg/m3 (1 h) VLPS = 200 µg/m3 (moyenne horaire) |
| NO | Chimiluminescence ozone DOAS LIDAR | |
| N2O | CPG/ECD (détecteur à Captures d’électrons) TDL (Diodes Laser) | |
| O3 | Méthode à l'iodure de potassium Chimiluminescence (éthylène) Photométrie dans l’UV DOAS LIDAR Tubes passifs Microcapteurs | OQ = 120 µg/m3 (8 h) Seuil information : 180 µg/m3 (1 h) SA = 240 µg/m3 (1 h) (+ niveaux protection végétation, forêts et matériaux) |
| CH4 | CPG/FID (détecteur à ionisation de flamme) TDL (Diodes laser) | |
| CO | Absorption IR Absorption IR - Corrélation par filtres gazeux | VLPS = 10 mg/m3 (8 h ) |
| COVT / COVTNM | Ionisation de flamme | |
| : - BTX : benzène, toluène, xylènes - hydrocarbures volatils : . alcanes, alcènes . aldéhydes | CPG/FID, PID (automatique) DOAS LIDAR Canisters Tubes actifs + analyse CPG Pièges passifs Tubes imprégnées + analyse HPLC | OQ = 2 µg/m3 (1 an) Benzène VLPS = 5 µg/m3 (1 an) Benzène |
| - méthodes gravimétriques : . filtres . continu - méthodes aérodynamiques - méthodes dimensionnelles : . optiques . électriques - fraction carbonée | Microbalance oscillante TEOM Absorption rayons β (jauge β) Impacteurs en cascade Fumées noires FN Compteur LIDAR ELPI (Electrical Low Pressure Impactor) ADME (Analyseur Différentiel de Mobilité Electrique) CNC (Compteurs Noyaux de Condensation) Carbone organique et C élémentaire | OQ = 30 µg/m3 (1 an) VLPS = 50 µg/m3 |
| HAP gaz + particules | - Prélèvements HVS (grands volumes) sur filtres et possibilité sur cartouches (polymère XAD2 ou PUF) puis analyses par HPLC et détection par fluorimétrie ou analyses par GC/MS - Prélèvements LVS (bas volumes) sur filtres et possibilité sur cartouches ; analyses idem | Valeur cible BaP (projet) : 1ng/m3 (moyenne annuelle) |
| Pesticides gaz + particules | Prélèvements HVS ou LVS (grands ou bas volumes) sur filtres quartz et cartouches (mousse PUF ou polymère XAD2) puis analyses par CG/HPLC et détection par ECD/TSD/UV-DAD/Masse | |
| Dioxines/Furanes gaz + particules | Prélèvements HVS filtres + cartouches puis analyses par GC/MS haute résolution. | |
| Métaux lourds : - Pb, Cd, Ni, As (particules) - Hg (gaz+particules) | Filtres - Analyses : AA - Fluo X - ICP - Prélèvements sur adsorbants solides + or et analyses par fluorescence atomique - Mesures instrumentales séquentielles continues (même principe). |
(1) Pour plus de détails, se reporter aux fiches C2 (Mesures in situ : gaz, Mesures in situ : particules) et à la fiche C3 (Mesures par télédétection).
(2) Pour plus d'informations, se reporter aux textes réglementaires. Ne sont données ici que des informations partielles.